Навигация
Энергетические параметры обобщённой теории «регулярных» растворов для систем Cu – Fe, Cu – Mn, Ni – Fe, Ni – Mn, Fe – Mn
1.5 Энергетические параметры обобщённой теории «регулярных» растворов для систем Cu – Fe, Cu – Mn, Ni – Fe, Ni – Mn, Fe – Mn
Железо условно обозначено, как компонент 3, а марганец – как компонент 4. Так как основные компоненты (медь и никель) образуют раствор с решёткой ГЦК, то и железо и марганец при растворении перестраиваются в ГЦК решётку. Поэтому все значения энергий смешения приведены для решётки ГЦК. Они представлены в табл. 1.8 – 1.9.
Табл. 1.8. Температурные зависимости энергий смешения
| Бинарная система |
|
| Ссылка | |
| Cu – Fe | 1; 3 |
|
| [13] |
| Cu – Mn | 1; 4 |
|
| [12] |
| Ni – Fe | 2; 3 |
|
| [13] |
| Ni – Mn | 2; 4 |
|
| [13] |
| Fe – Mn | 3; 4 |
|
| [13] |
Табл. 1.9. Значения энергий смешения при Т=298 К
| Бинарная система |
|
| |
| Cu – Ni | 1; 2 | -16369 | 24137 |
| Cu – Fe | 1; 3 | 37800 | 37800 |
| Cu – Mn | 1; 4 | 1252 | 1252 |
| Ni – Fe | 2; 3 | -37253 | 1796 |
| Ni – Mn | 2; 4 | -61192 | -48640 |
| Fe – Mn | 3; 4 | -13808 | -13808 |
1.6 Диаграммы состояния систем Cu – O и Ni – О
Фазовая диаграмма состояния Cu – O приведена на рис. 1.3 [9].
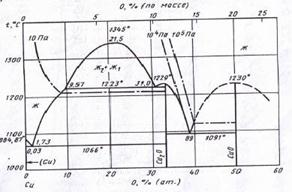
Рис. 1.3. Диаграмма состояния Cu – O.
Из рис. 3. следует, что при температурах ниже 1000˚С в системе медь – кислород наблюдается следующая последовательность равновесий
Cu | Cu2O | CuO | {O2}.
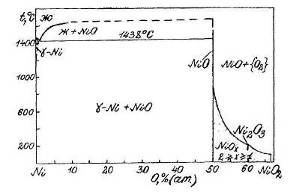
Фазовая диаграмма состояния Ni – O приведена на рис. 1.4 [14].
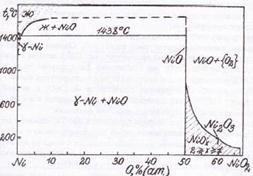
Рис. 1.4. Диаграмма состояния Ni – O
Из рис. 1.4. следует, что при температурах ниже 200˚С в системе никель – кислород наблюдается следующая последовательность равновесий Ni | NiO | NiOx | NiO2 | {O2}.
Здесь NiOx – фаза нестехиометрического состава, непрерывный ряд твёрдых растворов между NiO и NiO2. 1<x<2.
1.7 Диаграммы рН – потенциал систем Cu – H2O и Ni – H2O
Диаграмма рН – потенциал системы Cu – H2O приведена на рис. 1.5. Основные химические и электрохимические равновесия указаны в табл. 1.10.
Диаграмма рН – потенциал системы Ni – H2O приведена на рис. 1.6. Основные химические и электрохимические равновесия указаны в табл. 1.11.
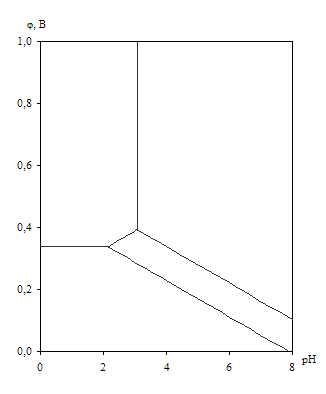
Рис. 1.5. Диаграмма рН – потенциал системы Cu – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов).
(негидратированная форма оксидов).
Табл. 1.10. Основные химические и электрохимические равновесия в системе Cu – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов)
(негидратированная форма оксидов)
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| 0,337 |
| 2 |
| 0,463–0,0591pH |
| 3 |
| 0,575–0,0591pH |
| 4 |
| 0,211+0,0591pH |
| 5 |
| pH 3,08 |
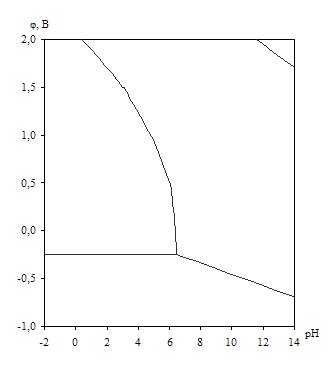
Рис. 1.6. Диаграмма рН – потенциал системы Ni – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов).
(негидратированная форма оксидов).
Табл. 1.11. Основные химические и электрохимические равновесия в системе Ni – H2O при 25оС, ![]() атм. (воздух) и
атм. (воздух) и ![]() (негидратированная форма оксидов)
(негидратированная форма оксидов)
| № линии | Электродная реакция | Равновесный потенциал (В) или рН раствора |
| 1 |
| -0,250 |
| 2 |
| 0,133–0,0591pH |
| 3 |
|
|
| 4 |
| 3,36–0,1182pH |
Как видно из рис. 1.5., на диаграмме рН – потенциал системы Cu – H2O можно выделить 4 области преобладания различных фаз:
I – Cu
II – Cu2+
III – Cu2O
IV – CuO.
В области I медь не подвержена коррозии (область иммунности). В области II медь переходит в раствор в виде двухзарядных ионов (область активной коррозии). В областях III и IV на поверхности меди образуется плёнка оксида – Cu2O в области III и CuO области IV (области пассивности).
На диаграмме рН – потенциал системы Ni – H2O (рис. 1.6.) также можно выделить 4 области преобладания различных фаз:
I – Ni – область иммунности
II – Ni2+ – область активной коррозии
III – NiOx – область пассивности
IV – ![]() – область транспассивности.
– область транспассивности.
Похожие работы
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...







0 комментариев