Навигация
Корректировка только диагональных силовых коэффициентов, а недиагональные оставлять без изменений
1. Корректировка только диагональных силовых коэффициентов, а недиагональные оставлять без изменений.
2. Использование одного общего корректирующего множителя для всех недиагональных силовых постоянных.
Подбирать значения корректирующих множителей только для диагональных членов, а корректирующие множители для недиагональных коэффициентов вычислять как среднее геометрическое из соответствующих диагональных величин.
2.2 ВыводВ данной главе были рассмотрены возможности программы HyperChem для расчета геометрических и физико–химических параметров молекул и проведена сравнительная оценка используемых методов. Из приведенных выше данных видно, что наибольшей точностью обладают методы ab initio и АМ1. Этими методами и будет производиться расчет соединений сульфаниламидного ряда. Для сравнительной оценки также включен в расчет метод INDO.
В следующей главе будут представлены рассчитанные геометрические параметры молекул сульфаниламидного ряда и рассчитанная физиологическая активность этих соединений. Следует сказать, что вначале проводился расчет геометрии приведенных соединений, затем просчитанные соединения были проверены на наличие физиологической активности.
Глава 3 СУЛЬФАНИЛАМИДНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
3.1 История открытия сульфаниламидов
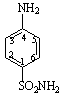
Сульфаниламидными препаратами называются лекарственные вещества, содержащие сульфамидную группу, большей частью производные бензосульфамида (1). Простейшим из них является п – аминобензолсульфамид (2) сульфаниламид или амид сульфониловой кислоты. Он впервые синтезирован Гельмо в 1908 году среди других производных анилина. В 1909 году были сделаны попытки использования сульфаниламида в качестве диазосоставляющей азокрасителей (для шерсти).
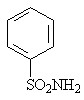
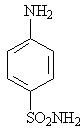
1 2
В 1919 году был синтезирован производное сульфаниламида путем его диазотирования (3) и его последующего сочетания с дигидрокупреином (4), но обнаруженное противострептококковое действие было приписано купреновому ядру.
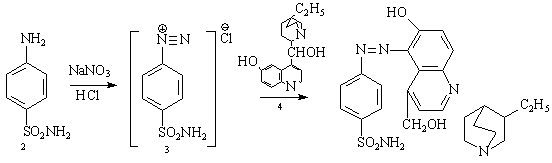
Клалер синтезировал несколько красителей этого типа, испытанных Домагком на проявление бактерицидных свойств, при этом было обнаружена эффективность действия их на белых мышей, зараженных вирулентным штаммом β – гемолитического стрептококка. Догмак установил ценные химиотерапевтические свойства сульфаниламидных азокрасителей, в том числе γ–амино-N- вторичноизопропилкарбинол-М-метилфенилсульфамида (5).
5
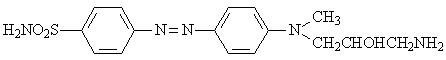
Выявленные бактерицидные свойства были впервые приписаны наличию сульфаниламидной группировки. Из синтезированных впоследствии более простых по структуре сульфаниламидных препаратов наибольшее внимание привлек сульфамид хризоидина (6), хлористоводородная соль, которого была названа пронтозилом.
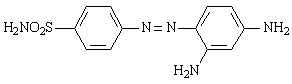
6
В СССР этот препарат синтезирован и внедрен в производство О.Ю. Магидсоном и М.В. Рубцовым в 1936 году под названием красного стрептоцида.
В отличие от незамещенного хризоидина, сульфамид оказался активным в отношении стрептококков in vivo, но плохо растворялся в воде, что затрудняло его использование. Для увеличения растворимости сульфаниламидных красителей были синтезированы препараты, в которых азосоставляющая представляла сульфокислоты нафталинового ряда. Один из них был вскоре введен в медицину под названием растворимого пронтозила (7).
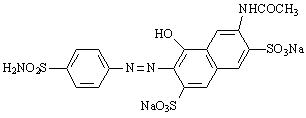
7
В СССР к этому времени было освоено производство красного растворимого стрептоцита (8) с азосоставляющей Н – кислотой.
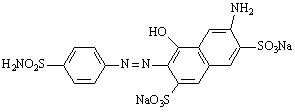
8
Получение пронтозилов явилось крупным событием в химиотерапии; впервые были получены вещества, пригодные для лечения различных септических процессов, вызываемых стрептококком, ранее часто кончавшихся летальным исходом.
Вскоре, однако, было установлено, что пронтозилы и сходные по структуре сульфаниламидные азокрасители не являются непосредственно противострептококковыми средствами и что проявлению химиотерапевтической активности таких красителей предшествует восстановление их в организме в сульфаниламиды:
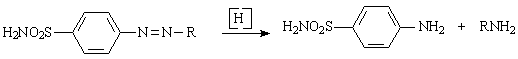
Образующийся одновременно с ним амин является либо излишним балластом, либо причиной токсического действия. Использованные впоследствии недиазотированные сульфаниламиды оказались более эффективными. Было выявлено, что в моче экспериментальных животных, подвергавшихся лечению сульфаниламидными азокрасителями, наряду с последними, выявлен сульфаниламид. Испытание последнего на больных стрептококковыми инфекциями показало высокие терапевтические свойства.
В СССР препарат был назван белым стрептоцидом. Ценные химикотерапевтические свойства сульфаниламида, обнаруженные спустя 27 лет после его открытия, побудили проверить ранее известные его производные. При изучении последних выявилось, что химиотерапевтическим эффектом обладают лишь производные пара - изомера. Ввиду специфического влияния сульфаниламидов, тесно связанного с ориентацией амино - и сульфамидной групп в их молекуле, для них принята следующая нумерация:
Изучение многочисленных соединений, в которых 1 – сульфамидная группа замещена на тиофенольную (9), сульфидную (10), дисульфидную (11), сульфоксидную (12) и сульфоновую (13) группы не привело к увеличению активности.
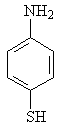
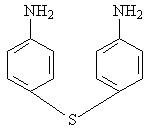
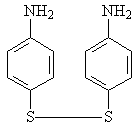
9 10 11
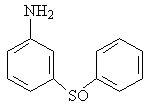
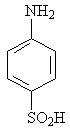
12 13
Испытание амидов сульфокислот различных ароматических и гетероциклических аминов, содержащих амино- и сульфамидную группы в параположении друг к другу, например амид нафталиновой кислоты (14), сульфамид амидопиридина (15), изохинолина (16) и других также не привело к созданию лекарственных препаратов, более активных, чем сульфаниламид.
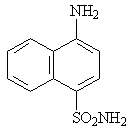
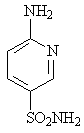
14 15 16
В дальнейшем было выяснено, что сульфаниламиды не уничтожают болезнетворные микроорганизмы, а лишь тормозят их рост и развитие; такой эффект в отличие от действия дезинфицирующих веществ был назван бактериостатическим.
3.2 Физические свойства сульфаниламидовВсе сульфаниламиды — белые или слегка желтоватые порошки без запаха, некоторые — горького вкуса. Большинство из них плохо растворимы в воде, лучше — в разбавленных кислотах и водных растворах щелочей (кроме сульгина). Повышение температуры растворителя улучшает растворимость препаратов. Смесь двух или более сульфаниламидов растворяется несколько лучше, чем любой из ее компонентов в отдельности. Хорошей растворимостью обладает только сульфацил.
Сульфаниламиды амфотерны, они образуют соли с сильными щелочами (за исключением сульгина) и с сильными кислотами. Некоторые соли сульфаниламидов легко растворимы в воде, их можно применять для внутривенных инъекций, когда необходимо быстро создать высокую концентрацию препарата в крови и органах. В связи с тем, что натриевые солив водных растворах имеют сильную щелочную реакцию (рН 10,5—12,5), при подкожном и внутримышечном введении они оказывают сильное раздражающее действие. Инфильтрация места введения изотоническим раствором хлорида натрия может ослабить некроз тканей, а инфильтрация раствором новокаина значительно уменьшает болевую реакцию. По этой же причине неразведенные натриевые соли не следует давать внутрь.
В растворах сульфаниламиды диссоциируют на ионы. Фармакологическая активность связана с их константами диссоциации. Так, например, бактериостатическое действие сильнее выражено в щелочных растворах, так как в этих условиях больше образуется ионов. Хорошо диссоциируют норсульфазол, сульфацил, значительно хуже — стрептоцид. Соединения, более способные к кислотной диссоциации, лучше всасываются. Сульфаниламидные препараты хорошо растворимы в биологических жидкостях, в том числе в плазме крови.
3.3 Механизм действия сульфаниламидовПрепараты этой группы относятся к химиотерапевтическим средствам широкого антибактериального спектра действия, так как они подавляют жизнедеятельность многих видов бактерий: стрептококков, стафилококков, менингококков, гонококков, бактерий кишечно-тифозно-дизентерийной группы и многих других. Сульфаниламиды активны в отношении крупных вирусов (возбудителей трахомы, пахового лимфогранулематоза), кокцидий, плазмодий малярии и токсоплазм, актиномицет и т.д.
Сульфаниламидные препараты в небольших концентрациях задерживают рост и развитие бактерий, то есть действуют бактериостатически. Бактерицидное влияние они оказывают лишь при воздействии таких высоких концентраций, которые небезопасны для макроорганизма.
![]()
![]()
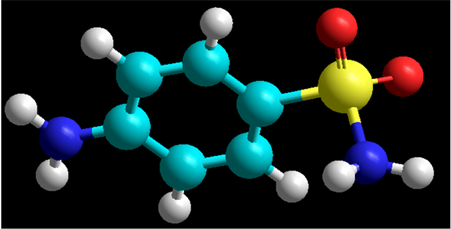
Рисунок 3.1.1 Реакционные центры сульфаниламида.
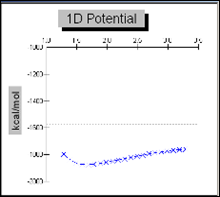
График 3.1.1 Поверхность потенциальной энергии для связи С-S в молекуле сульфаниламида
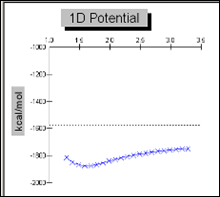
График 3.1.2 Поверхность потенциальной энергии для связи S-N в молекуле сульфаниламида
Важнейшая особенность сульфаниламидов — высокая активность in vivo при сравнительно более слабом действии in vitro. Под их воздействием микробы разбухают, перестают размножаться, продуцировать токсины, становятся более уязвимыми для защитных сил организма. Установлена избирательная способность отдельных препаратов в отношении определенных возбудителей инфекционных болезней. Так, норсульфазол и сульфазол более активны при стафилококковых инфекциях, стрептоцид. — при стрептококковых, а сульфапиридазин весьма эффективен при сепсисе, вызванном бактерией коли, сульфатиазол (17) в 70 – 80 раз активнее сульфаниламида, а сульфоидин (18) лишь в 8 раз.
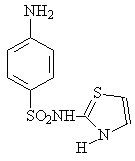
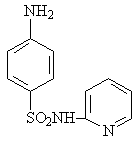
17 18
Бактериостатический эффект зависит от химического строения препарата, степени и силы связывания с белками плазмы, реакции среды, константы диссоциации и других факторов. Большое значение имеет состояние нервной системы, защитных сил макроорганизма, которым принадлежит ведущая роль в. окончательной ликвидации инфекционного процесса.
В основе механизма действия сульфаниламидных препаратов лежит антагонизм между сульфаниламидами и парааминобензойной кислотой (ПАБК) В силу структурного сходства молекулы парааминобензойной кислоты и сульфаниламидов последние способны вытеснять ПАБК из ферментных систем микроорганизма. Сульфаниламиды нарушают процесс получения микробами необходимых для их развития "ростовых факторов" — фолиевой кислоты и других веществ, в молекулу которых входит ПАБК. Под действием препаратов в микробной клетке нарушается синтез метионина, пуриновых и пиримидиновых оснований, что в свою очередь приводит к нарушению синтеза нуклеиновых кислот и нуклеопротеидов.
Бактериостатическое действие сульфаниламидов проявляется только при определенной концентрации препаратов в окружающей микробов среде. Эта концентрация должна быть достаточна для предотвращения использования микроорганизмами парааминобензойной кислоты, содержащейся в тканях. Чем выше концентрация ПАБК, тем больше требуется сульфаниламидного препарата для наступления антимикробного эффекта. Установлено, что для нейтрализации одной части ПАБК требуется 1600 частей стрептоцида, 100 частей сульфазина и 36 частей норсульфазола.
Некоторые сульфаниламиды проявляют конкурентный антагонизм и в отношении других ферментных систем, в частности они нарушают процесс декарбоксилирования пировиноградной кислоты, окисления глюкозы
Механизм антимикробного действия сульфаниламидных препаратов определяется не только конкурентными взаимоотношениями между сульфаниламидами и парааминобензойной кислотой. Сульфаниламиды препятствуют синтезу дигидрофолиевой кислоты в микроорганизме из глютаминовой и парааминобензойной кислот. Белковые вещества (гной, мертвые ткани), содержащие большое количество ПАБК, а также некоторые лекарственные препараты, в молекулу которых входит остаток парааминобензойной кислоты (новокаин, анестезин), являются ингибиторами активности сульфаниламидов. В то же время присутствие мочевины повышает их бактериостатическую активность.
Микроорганизмы в процессе своего роста и развития синтезируют фолиевую кислоту, которая контролирует биосинтез аминокислот, пуриновых и пиримидиновых оснований. Структура нормальной фолиевой кислоты содержит фрагмент ПАБК. Сульфаниламиды, вследствие их структурной близости, способны аналогичным путем вступать во взаимодействие с таким – же коллоиднобелковым носителем. Образующийся при этом новый комплекс, в отличие от активного фермента, уже не обладает способностью стимулировать рост микроорганизмов.
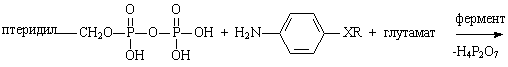
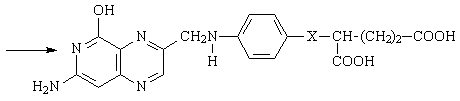
Х – СО, фолиевая кислота
Х – SO2, псевдофолиевая кислота
ХR – COOH, SO2NH2
Воздействие малыми дозами или назначение сульфаниламидов с большими интервалами приводит к развитию приспособительной реакции у микробов, изменению пути образования нужных им для роста и размножения энзимных систем. Вследствие этого возникают сульфаниламидо - устойчивые расы микроорганизмов. Блокада ПАБК сульфаниламидами существенно не нарушает жизнедеятельности микробов.
Устойчивость микроорганизмов, приобретенная к одному сульфаниламидному препарату, распространяется и на другие препараты этой группы (полная перекрестная устойчивость). Приобретенная резистентность бактерий к сульфаниламидам, связанная с повышенной выработкой ими ПАБК, может быть генетически наследуемой.
Сульфаниламидные соединения обладают широким диапазоном действия на макроорганизм и должны рассматриваться как специфические нервные раздражители. Они снижают повышенную реактивность организма, оказывают жаропонижающий эффект. Сульфаниламидные препараты действуют противовоспалительно, вызывают угнетение процессов регенерации при местном применении; снижают активность нуклеофосфатазы печени, почек, селезенки, нарушают нормальные процессы ацетилирования, являясь специфическим ингибитором угольной ангидразы, уменьшают способность плазмы к связыванию углекислоты, тормозят газообмен, снижают активность других ферментных систем, стимулируют процесс фагоцитоза, повышают устойчивость организма к токсинам.
Благодаря сочетанию противоаллергических, антипиретических свойств с бактериостатическим действием сульфаниламиды можно использовать при различных заболеваниях, сопровождающихся воспалительными процессами. Воздействие их на микро - и макроорганизм дополняют друг друга, обеспечивая хорошо выраженный терапевтический эффект.
Сульфаниламидные препараты малотоксичны. Однако длительное применение их в завышенных дозах может привести к развитию токсических, эффектов. При недостаточной функции почек или при назначении больших доз препаратов могут возникать явления кристаллурии. Правильное назначение сульфаниламидов больным не вызывает побочных эффектов.
Большинство сульфаниламидов легко всасывается из ЖКХ (стрептоцид, норсульфазол, этазол, сульфазин, сульфадимезин, сульфапиридазин, сульфадиметоксин и др.) и быстро накапливается в крови, органах и тканях в бактериостатических концентрациях, проникает через гематоэнцефалический барьер. Основная масса препаратов всасывается в тонком отделе кишечника. Скорость всасывания зависит от степени кислотной диссоциации. Очень хорошо всасываются натриевые соли препаратов. Некоторые сульфаниламиды, такие, как фталазол, сульгин, фтазин, трудно всасываются, относительно долго находятся в кишечнике в высоких концентрациях и выделяются преимущественно с фекалиями, поэтому их применяют главным образом при заболеваниях ЖКХ.
В организме человека сульфаниламидные соединения, как и другие лекарственные вещества, подвергаются расщеплению, окислению, ацетилированию. Особенно большое значение для клинической практики имеет процесс ацетилирования. Он происходит главным образом в печени как за счет уксусной кислоты, поступающей извне, так и за счет кислоты, образующейся в организме из пировиноградной кислоты.
В здоровом организме степень ацетилирования несколько выше, чем в инфицированном. Кроме того, степень ацетилирования сульфаниламидов возрастает при их продолжительном применении, понижении диуреза, заболеваниях почек, сопровождающихся почечной недостаточностью.
Ацетилированные производные сульфаниламидов не действуют на микроорганизмы и значительно хуже растворяются в воде. Вследствие плохой растворимости, особенно в кислой моче, ацетопродукты выпадают в осадок с образованием конгломератов, закупоривающих просвет почечных канальцев с последующим нарушением диуреза.
В терапевтическом отношении особенно ценны препараты быстро всасывающиеся из желудочно-кишечного тракта и мед ленно выделяющиеся из организма. В зависимости от скорости элиминации сульфаниламидов из организма их подразделяю на три группы:
1) препараты быстрого действия (стрептоцид, норсульфазол этазол, сульфацил, уросульфан, сульфадимезин и др );
2) препараты средней продолжительности действия (сульфазин, метилсульфазин и др.),
3) препараты длительного и сверхдлительного действий (сульфапиридазин, сульфадиметоксин, сульфамонометоксин, сульфален и др). В приложении Б подробно рассмотрены сульфамиламидные лекарственные вещества.
Скорость выведения из организма в значительной мере определяет величину дозы и частоту приема препарата. Показателем скорости выведения служит величина Т50%, или T1/2, - период полувыведения, то есть время снижения максимальной концентрации в крови в 2 раза. У препаратов короткого действия T1/2 менее 8 ч, средней продолжительности действия - 8—16 ч и у препаратов длительного и сверхдлительного действия — 24—56 ч и более.
Сульфаниламидные препараты длительного действия хорошо всасываются из ЖКХ, создавая высокие концентрации в крови, а самое главное — длительна задерживаются в организме. Их можно назначать в значительно меньших дозах и через более продолжительные интервалы между введениями. Указанные свойства значительно расширяют перспективу применения соединений этой группы в ветеринарной практике.
Сульфаниламиды показаны для лечения инфекционных заболеваний дыхательных путей (трахеита, бронхита, пневмоний, гнойных плевритов и др.), желудочно – кишечных заболеваний различной этиологии (диспепсии, кокцидиоза, дизентерии, гастроэнтероколитов и т. д.); рожистого воспаления, мыта, послеродового сепсиса, пиелита, цистита, сальмонеллеза, колибактериоза, пастереллеза, раневых и других инфекций, вызванных микроорганизмами, чувствительными к сульфаниламидам.
Противопоказаний к применению сульфаниламидных препаратов больным немного: общий ацидоз, заболевания кроветворной системы, гепатиты.
3.4 Синтез сульфаниламидовИсходным продуктом синтеза препаратов является анилин. Аминогруппу анилина замещают остатком уксусной кислоты и проводят сульфохлорирование. Далее проводят замену галогена в хлорангруппе замещенной сульфаниловой кислоты на аминогруппу и гидролизом удаляют защитную группу [24]:
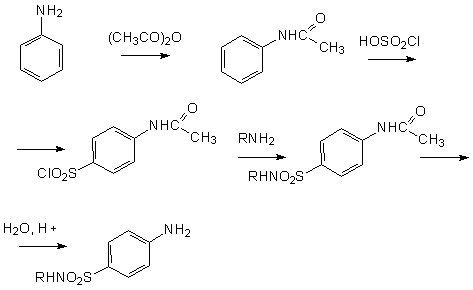
Ниже представлена схема синтеза четырех лекарственных веществ сульфаниламидной серии: сульгина (19), сульфадимезина (20), норсульфазола (21) и сульфафуразола (22), получаемых типичной конденсацией ароматического сульфанилхлорида с различными аминными компонентами:
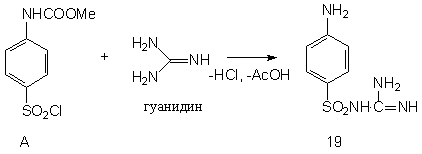
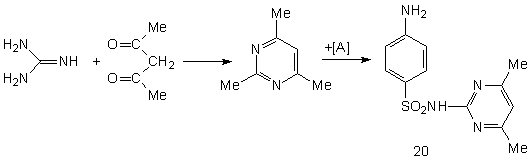
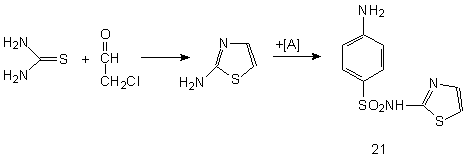
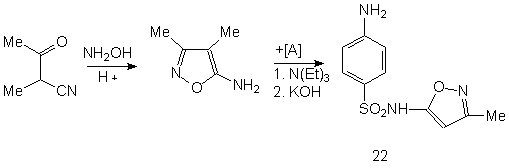
Ниже в данной работе будут представлены геометрические и физико - химические параметры данных молекул рассчитанные в программе HyperChem и проявляемая ими физиологическая активность, рассчитанная в программе PASS C&T.
3.5 Расчитанные параметры молекул 3.5.1 СульфаниламидВ приложении В представлена молекула сульфаниламида (стрептоцита белого) с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфаниламида в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как агонист Допамина Д4 (0,941), кардиовезикулярный аналептик (0,857), ингибитор циклооксагеназы 1 (0,847), диуретик (0,776), антиэпилептик (0,681) и другие;
предсказано несколько видов токсичности (гематоксичность (0,933) и эмбриотоксичность (0,495)).
3.5.2 СульгинВ приложении Г представлена молекула сульгина с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульгин в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как ингибитор пируваткиназы (0,863), ингибитор катепсина G (0,769), антиэпилептик (0,617), агонист Допамина Д4 (0,692);
предсказана гематоксичность (0,947).
3.5.3 СульфадимезинВ приложении Д представлена молекула сульфадимезина с рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфадимезина в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как агонист Допамина Д4 (0,708), антидиабетик (0,536);
предсказана гематоксичность (0,791).
3.5.4 НорсульфазолВ приложении Е представлена молекула норсульфазола рассчитанными геометрическими параметрами молекулы и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность норсульфазола в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как Antiobesity (0,885), агонист Допамина Д4 (0,785), агонист простагландина (0,549);
предсказана гематоксичность (0,791).
3.5.4 СульфафуразолВ приложении Ж представлена молекула норсульфазола с рассчитанными геометрическими параметрами молекулы методами и видами проявляемой физиологической активности (жирным шрифтом выделены активности, известные из эксперимента). Из данного приложения видно, что:
подтверждена активность сульфафуразола в отношении ПАБК;
получены вероятности нахождения других видов активности, такие как антагонист простагландина Н2, антагонист эндотелинового рецептора (0,674), ингибитор тиолоксидазы (0,620) агонист Допамина Д4 (0,581);
предсказано несколько видов токсичности (гематоксичность (0,833) и эмбриотоксичность (0,339)).
ЗАКЛЮЧЕНИЕ
В ходе проведенной работы были рассчитаны геометрические параметры соединений сульфаниламидного ряда и предсказана вероятность проявления ими некоторых видов физиологической активности. Результатом работы стал прогноз ранее неизвестных видов активности у соединений сульфаниламидного ряда, к которым можно отнести агонист Допамина Д4 (проявляется у всех анализируемых веществ с вероятностью 0,581 – 0,941), гематоксичность (проявляется у всех соединений с вероятностью 0,791 – 0,947), эмбриотоксичность (проявляется у сульфафуразола и сульфаниламида с вероятностью 0,339 и 0,495) и другие. Вместе с тем была подтверждена уже известная проявляемая физиологическая активность (антагонист ПАБК), которая оценена на уровне 0,860 – 0,9, что является очень высоким показателем. Как показано в приложениях В – Ж, имеет смысл провести дополнительные доклинические испытания на пример использования их в качестве антиэпилептического назначения.
СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ
1 Prous J. Drugs Years News[Text] / Proc. Natl. Acad. Sci. USA. 1995. P 345
2 Djons A. Talidomid as anxiolitic [Text] / Brit. J. Pharmacol., 1960, 15, p.111-116
3 Am. J. Public Health, 1965, 55, p.703-707
4Sridhar B., Ravikumar K. Some interesting properties of talidomid [Text] / Proc. Natl. Acad. Sci. USA. 1994, Apr 26; 91 (9):4082-5
5 Clin. Immunol. Immunopathol. 1996, 81, p.219-223
6 Иванов А.С., Арчаков А.И. Интегральная платформа «От гена до прототипа лекарства» in silico и in vivo [Текст] / Иванов А.С. Арачаков А.И. // Российский химический журнал М.: Наука №2, 2006. – с. 18-35
7 Жидомиров Г.М., Багатурьянц А.А. Прикладная квантовая химия.-М.: Химия, 1979.-295 с.
8 Бурштейн К.Я., Шорыгин П.П. Квантово- химические расчеты в органической химии и молекулярной спектроскопии.- М.: Наука, 1989.-310 с.
9 Кузнецов П.Е., Люлин Ю.Н., Щербаков А.А. Методы математического моделирования в приложении к проблеме биофизической химии. ДСП, 1985.-250 с.
10 Hansch C, Fujita Т., р-ст-л Analysis. A Method for the Correlation of Biological Activity and Chemical Structure, J. Am. Chem. Soc, 86, 1616 (1964).
11 Hammett L. P., Physical Organic Chemistry, McGraw-Hill, New York, 1940.
12 Cramer R. D., Quantitative Drug Design, in: Annual Reports in Medicinal Chemistry, Vol. 11, F. H. Clarke (Ed.), Academic, New York, 1976.
13 Silipo C, Hansch C, Correlation Analysis. Its Application to the Structure -Activity Relationship of Triazines Inhibiting Dihydrofolate Reductase, J. Am.Chem. Soc, 97, 6849 (1975).
14 Dixon W. J. (Ed.), BMD - Biomedical Computer Programs, 3rd ed., Universityof California Press, Berkeley, CA, 1973.
15 Furnival G. M., Wilson R. W., Jr., Regressions by Leaps and Bounds, Tech-nometrics, 16, 499 (1974).
16 Стьюпер Э., Брюггер У. Машинный анализ связи химической структуры и биологической активности. Пер. с англ. — М.: Мир, 1982.—235 с, ил.
17 Сборник программ расчета спектральных и квантовохимических параметров молекул. ДСП, 1983.-53 с.
18 Hartigan G. H., Clustering Algorithms, Wiley, New York, 1975.
19 Ball G. H., Hall J. P., ISODATA: A Novel Method of Data Analysis and Pattern Classification, NTIS Report AD699616, 1965.
20 Ball G. H., Hall J. P., ISODATA, An Iterative Method of Multivariate Analysis and Pattern Classification, Proceedings of the IFIPS Congress, 1965.
21 По материалам сайта ChemNet
22 Shroder S., Thiel W. //Ibid. Vol. 108, N 25. P. 7985 - 7989
23 Dewar M.J.S., Ford G.P. // J. Amer. Soc. 1977. Vol. 99, N6. P. 1685-1691
24 Вартанян Р.С. Синтез основных лекарственных средств. – М. Медицинское информационное агентство, 2004. – 845 с.
Приложение А
Таблица А.1 - Абсолютные ошибки, которые получаются при расчете длин валентных связей и значений валентных углов неэмпирическими методами.
| Неэмпирический расчет в базисе | Ошибки | |
| Длины валентных связей, нм | Валентные углы, град | |
| ОСТ-3ГФ | 0,002-0,003 | 3-4 |
| Валентно - расщепленные базисы, безэкспоненциальные базисы, расширенные базисы без поляризационных орбиталей | 0,001 | Сильное завышение валентных углов у молекул типа Н2О, NН |
| Валентно - расщепленные и безэкспоненциальные базисы с поляризационными орбиталями | 0,0011 | 1-2 |
| Хартри- Фоковский предел | 0,005 | 1-2 |
| Большие базисы с учетом электронной корреляции | Очень хорошее согласие с экспериментом | |
Примечание 1 - вычисленные значения обычно меньше экспериментальных величин
Таблица А.2 - Абсолютные значения ошибок при расчете длин валентных связей и валентных углов методами МПДП и МЧПДП/3
| Геометрический параметр | Количество расчетов | Абсолютная ошибка | |
| МПДП | МЧПДП/3 | ||
| Валентная связь, нм | |||
| Все тины связей | 228 | 0,0014 | 0,0022 |
| С-Н | 56 | 0,0009 | 0,0019 |
| С-С | 96 | 0,0012 | 0,0016 |
| N-H | 9 | 0,0006 | 0,0019 |
| N-C | 17 | 0,0010 | 0,0029 |
| N-N | 9 | 0,0032 | 0,0074 |
| O-H | 7 | 0,0011 | 0,0010 |
| O-C | 22 | 0,0016 | 0,0025 |
| O-N | 8 | 0,0026 | 0,0026 |
| O-O | 3 | 0,0117 | 0,0043 |
| Валентный угол, град | |||
| Все типы углов | 91 | 2,8 | 5,6 |
| Углы при С | 62 | 2,0 | 4,4 |
| Углы при N | 15 | 3,2 | 7,1 |
| Углы при О | 9 | 8,5 | 10,7 |
| Углы между плоскостями в бициклических соединениях | 5 | 1,6 | 5,9 |
Таблица А.3 - Потенциалы ионизации, эВ
| Соединение | МПДП | Эксперимент | Отнесение1 | Соединение | МПДП | Эксперимент | Отнесение1 |
| Метан | 13,9 | 14,0 | 1t2 | Аммиак | 11,2 | 10,9 | 2a1 |
| 30,6 | 22,9 | 1a2 | 16,7 | 16,0 | 1e | ||
| Этан | 12,7 | 1eg | 32,9 | 27,0 | 1a1 | ||
| 13,3 | 12,1 | 2a1g | Цитанистый Водород | 13,4 | 13,6 | 1π | |
| 15,1 | 15,0 | 1eu | 14,3 | 14,0 | 3 | ||
| 24,8 | 20,4 | 1a2u | 21,6 | 20,0 | 2σ | ||
| Этилен Этилен | 10,2 | 10,5 | 1b1u | Азот Азот | 14,9 | 15,6 | 2σg |
| 12,6 | 12,8 | 1b1g | 16,2 | 17,0 | 1πu | ||
| 14,6 | 14,7 | 2ag | 21,1 | 18,8 | 1σu | ||
| 15,8 | 15,9 | 1b2u | Вода | 12,2 | 12,6 | 1b1 | |
| 14,5 | 14,7 | 2a1 | |||||
| Ацетилен | 11,0 | 11,4 | 1π u | 19,1 | 19,1 | 1b2 | |
| 15,9 | 16,4 | 2σg | 40,0 | 32,2 | 1a1 | ||
| 21,0 | 18,7 | 1σu | Диоксид Углерода | 12,8 | 13,8 | 1π g | |
| Бензол | 9,4 | 9,2 | 1e1g | 17,7 | 17,6 | 1π u | |
| 12,5 | 11,5 | 2e2g | 17,8 | 18,1 | 2σu | ||
| 12,6 | 12,3 | 1a2g | 21,2 | 19,4 | 2σg | ||
| 14,4 | 13,8 | 2e1u | Формаль дегид | 11,0 | 10,9 | 2b2 | |
| 15,2 | 14,7 | 1b2u | 14,2 | 14,4 | 1b1 | ||
| 16,8 | 15,4 | 1b1u | 16,3 | 16,0 | 2a1 | ||
| 17,5 | 16,9 | 2a1u | 16,9 | 16,8 | 1b2 |
Примечание 1 - отнесение, сделанное на основе данных метода МПДП, для большинства всех перечисленных в таблице соединений совпадает с общепринятым
Таблица А.4 - Экспериментальные теплоты образования и ошибки при вычислении этих величин квантовохимическими методами.
| Молекула | Экспериментальная величина НА | Ошибка при вычислении методом1 | ||
| 3-21ГФ | 6-31ГФ* | МПДП | ||
| 1 | 2 | 3 | 4 | 5 |
| Метан | -75 | -4 | 2 | 25 |
| Этан | -85 | 1 | 8 | 2 |
| Пропан | -104 | 2 | 8 | 0 |
| Этилен | -52 | -7 | -10 | 12 |
| Пропилен | 21 | 8 | -10 | 0 |
| цис - Бутен – 2 | -8 | - | 15 | -9 |
| транс – Бутен - 2 | -13 | -13 | 13 | -9 |
| H2C=CMe2 | -18 | -16 | 12 | 9 |
| H2C=C=CH2 | 192 | -11 | -29 | -8 |
| H2C=CH-CH=CH2 | 109 | -20 | 52 | 12 |
| C2H2 | 228 | -7 | -33 | 12 |
|
| 186 | 2 | -25 | -15 |
|
| 146 | 2 | 20 | -44 |
|
| 475 | 6 | 45 | -46 |
| Циклопропан | 53 | -35 | -10 | -6 |
| Циклопропен | 278 | -77 | -44 | 8 |
| Циклобутен | 158 | -47 | -34 | -26 |
| Бензол | 83 | -11 | 45 | 6 |
| H2O | -243 | -20 | -11 | -14 |
| H2O2 | -136 | 77 | 13 | -24 |
| CO | -111 | 39 | 56 | 85 |
| CO2 | -395 | 31 | 64 | 79 |
| CH3OH | -202 | 22 | -21 | -39 |
| C2H5OH | -236 | 23 | -20 | -29 |
| CH2O | -109 | 15 | 33 | -29 |
| HCOOH | -381 | 47 | -54 | -8 |
| CH3CHO | -167 | 15 | 83 | -11 |
| CH3COCH3 | -218 | 17 | -32 | 10 |
| CH3OCH3 | -185 | 48 | -44 | -30 |
| NH3 | -46 | -4 | -17 | 20 |
| N2H4 | 96 | 32 | -8 | -36 |
| цис – HN=NH | 214 | -33 | -16 | -72 |
| HN3 | 295 | -72 | 44 | 11 |
| Продолжение таблицы А.4 | ||||
| CH3NH2 | -23 | 14 | 0 | -8 |
| CH3NCH3 | -18 | 22 | 8 | -9 |
| HCN | 136 | 37 | 5 | 11 |
| CH3CN | 88 | 58 | 14 | -8 |
| CH3NC | 150 | 34 | - | 102 |
|
| 310 | 94 | 6 | -33 |
| HNO2 | -79 | -15 | - | -92 |
| N2O | 80 | -64 | -16 | 47 |
| Средняя ошибка | - | 29 | 25 | 26 |
Примечание 1 - при расчете теплот образования методами 3-21ГФ и 6-31ГФ* использованы корректирующие параметры из таблицы 1.5
Таблица А.5 - Корректирующие параметры для расчета теплот образования молекул неэмпирическими методами
| Атом | Метод | ||
| ОСТ-3ГФ | 3-21ГФ | 6-31ГФ* | |
| Н | -0,57429 | -0,56908 | -0,56912 |
| С | -37,40983 | -37,67347 | -37,88940 |
| N | -53,74645 | -54,14898 | -54,46617 |
| O | -73,77352 | -74,36308 | -74,78492 |
Таблица А.6 - Теплоты реакций изомеризации (кДж/моль)
| Реакция | МПДП | Эксперимент |
| СН3С≡H → СН2=С=CH2 | 12 | 6 |
|
| 105 | 86 |
|
| 26 | 32 |
|
| 2 | 2 |
|
| 4 | 4 |
|
| 23 | 12 |
|
| 13 | -5 |
|
| 2 | 8 |
|
| 31 | 31 |
|
| 5 | 4 |
|
| 42 | -23 |
| С2Н5NH2 → (СН3)2NH | 27 | 30 |
|
| 8 | 0 |
| СН3СN → СН3NС | 170 | 60 |
| С2Н5OH → СН3OСН3 | 48 | 49 |
|
| 113 | 113 |
| СН3СOOН → НСOOСН3 | 67 | 87 |
|
| 7 | 2 |
Таблица А.7 - Вычисленные энергии активации (кДж/моль) для реакций, приведенных на схемах 1 – 5.
| Реакция | МПДП | КМПДП | ХФ | КХФ1 |
| 1 | 400 | 331 | 344 | 327 |
| 2 | 523 | 420 | 483 | 419 |
| 3 | 627 | 589 | 638 | 559 |
| 4 | 343 | 316 | 315 | 286 |
| 5 | 396 | 271 | 212 | 202 |
| 6 | 458 | 390 | 437 | 402 |
| 7 | 405 | 299 | 455 | 361 |
| 8 | 84 | 96 | 119 | 131 |
| 9 | 538 | 502 | 550 | - |
| 10 | 568 | 540 | 483 | 430 |
| 11 | 458 | 382 | 411 | 436 |
| 12 | 425 | 347 | 426 | 403 |
| 13 | 453 | 323 | 348 | 378 |
| 14 | 341 | 349 | 338 | 353 |
| 15 | 318 | 268 | 278 | 262 |
| 16 | 78 | 38 | 26 | 23 |
| 17 | 360 | 201 | 218 | 161 |
| 18 | 444 | 352 | 397 | 326 |
| 19 | 609 | 467 | 538 | 428 |
| 20 | 370 | 238 | 254 | 200 |
| 21 | 399 | 372 | 452 | 390 |
| 22 | 286 | 280 | 250 | 186 |
| 23 | 403 | 310 | 420 | - |
| 24 | 437 | 275 | 319 | 259 |
Примечание 1 - при расчете энергии активации использована геометрия переходного состояния, предварительно вычисленная в приближении Хартри – Фока
Таблица А.8 - Статистический анализ результатов расчета геометрии переходных состояний и энергий активации методами МПДП и КМПДП
| Вычисленная величина | Число расчетов | Абсолютная ошибка1 | |
| МПДП | КМПДП | ||
| Длинна валентных связей2, нм Активных3 Пассивных3 | 112 70 42 | 0,0057 0,0078 0,0019 | 0,0056 0,0073 0,0025 |
| Валентный угол2 | 58 | 7,9 | 6,2 |
| Торсионный угол2, град | 20 | 11,6 | 7,9 |
| Энергия активации, кДж/моль | 24 | 55 904 | 45 364 |
Примечание 1 - по сравнению с данными неэмпирического расчета в приближении Хартри – Фока
Примечание 2 - для переходного состояния
Примечание 3 - активные связи разрываются или образуются в ходе реакции, пассивные связи в ходе реакции формально остаются неизменными
Примечание 4 - по сравнению с данными неэмпирических расчетов с учетом электронной корреляции
Приложение Б
СУЛЬФАНИЛАМИДЫ РЕЗОРБТИВНОГО ДЕЙСТВИЯ
Стрептоцид — Streptocidum. пара-Аминобензолсульфамид. Синонимы: пронтозил, стрептоцид белый, стрептамин, сульфаниламид, стрептозол и др.
Белый кристаллический порошок без запаха и вкуса. Мало растворим в воде, легко — в кипящей воде, растворах кислот и щелочей; трудно растворим в этаноле. Водные растворы имеют нейтральную реакцию, весьма стойкие. Несовместим с новокаином, анестезином, барбитуратами и другими препаратами, легко отщепляющими серу.
Оказывает противомикробное действие на стрептококков, менингококков, пневмококков, кишечную палочку, возбудителя газовой гангрены и некоторые другие микробы, но почти неактивен в отношении стафилококков. Препарат нарушает течение обменных процессов и тормозит рост и размножение микроорганизмов.
Стрептоцид быстро всасывается из желудочно-кишечного тракта, подкожной клетчатки и с раневой поверхности. Особенно хорошо всасывается из тонкого отдела кишечника, несколько хуже — из желудка и толстого отдела кишечника. При местном применении не раздражает тканей.
После перорального применения максимальная концентрация препарата в крови устанавливается через 0,5—3 ч и удерживается примерно на этом уровне в течение 1—2 ч, а затем довольно быстро снижается. Всосавшийся препарат легко проникает через внутренние барьеры. Его обнаруживают во всех органах и тканях в достаточно высоких концентрациях. В организме стрептоцид связывается с белками до 20 % и подвергается различным превращениям, в том числе ацетилированию. Степень ацетилирования в крови составляет 20—25 %, в моче — 25—60 %. Продукты ацетилирования не обладают антимикробной активностью и значительно хуже растворяются в воде. При высокой концентрации препарата в моче они могут выпадать в осадок. Выделяется стрептоцид в свободной и связанной формах преимущественно почками (90—95 %).
Токсичность препарата незначительна, но при длительном употреблении в больших дозах в почках могут образовываться трудно растворимые соединения, уменьшается содержание гемоглобина, возникают цианоз, агранулоцитоз, лейкопения. Противопоказания к применению стрептоцида следующие: общий ацидоз, гепатит, гемолитическая анемия, агранулоцитоз, нефриты, нефрозы.
Стрептоцид применяют при ангинах, стрептококковых тонзиллярных абсцессах, мыте, бронхопневмонии, послеродовом сепсисе и других заболеваниях. Дозы внутрь: лошадям и крупному рогатому скоту 5-10 г, мелкому рогатому скоту и свиньям 0,5-2, собакам 0,5-1, песцам и лисицам 0,3-0,5 г. Препарат назначают в указанных разовых дозах 4-6 раз в сутки в течение 5-7 дн. Разовые дозы внутривенно: лошадям и крупному рогатому скоту 3-6, собакам 0,5-1 2—3 раза в сутки. Наружно стрептоцид используют для лечения инфицированных ран, язв, ожогов в форме присыпки, суспензии, линимента. Перевязки проводят через 1—2 дня, так как гной и продукты распада тканей снижают лечебное действие стрептоцида.
Выпускают в форме порошка, таблеток по 0,3 и 0,5 г, а также в форме 5-10%-ной мази, 5%-ной суспензии и 5%-ного линимента.
Порошок и таблетки стрептоцида хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Мазь, суспензия и линимент стрептоцида хранят в прохладном, защищенном от света месте в тщательно закрытой упаковке. При появлении на поверхности линимента буроватой пленки ее следует удалить, после чего линимент пригоден к применению.
Стрептоцид растворимый — Streptocidum solubile. пара-Сульфамидо-бензоламинометансульфат натрия.
Белый кристаллический порошок. Растворим в воде, практически нерастворим в эфире и хлороформе. Водные растворы можно стерилизовать. Несовместим с новокаином, анестезином, барбитуратами.
По антпмикробному действию аналогичен стрептоциду. В связи с хорошей растворимостью в воде пригоден для парентерального введения. Фармакокинетика препарата сходна с фармакокинетикой стрептоцида.
Примрняют стрептоцид растворимый при септических стрептококковых процессах, ангинах, мыте, бронхопневмониях, маститах, циститах, пиелитах. Назначают внутримышечно и подкожно в форме 5%-ного раствора, приготовленного на воде для инъекций или изотоническом растворе хлорида натрия. Для внутривенного введения готовят 10%-ный раствор на изотоническом растворе хлорида натрия или 1—5 %-ном растворе глюкозы. Дозы внутривенно: лошадям и крупному рогатому скоту 2—6 г, мелкому рогатому скоту и свиньям 1—2, собакам 0,3—0,5 г. При маститах в пораженную долю вымени после сдаивания вводят 3—5 %-ный водный раствор препарата в объеме 25—40 мл 2—3 раза в сутки.
Растворимый стрептоцид можно назначать не только парентерально, но и внутрь, а также наружно в тех же дозах, что и стрептоцид.
Противопоказания к применению растворимого стрептоцида: болезни кроветворной системы, гепатиты, нефриты.
Выпускают растворимый стрептоцид в порошке. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Норсульфазол — Norsulfazolum. 2-(пара-Аминобензолсульфамидо)-тиазол. Синонимы: азосептал, пиросульфон, сульфатиазол, тиазамид, цибазол и др.
Белый или слегка желтоватый кристаллический порошок без запаха, очень мало растворим в воде (1 : 2000), мало — в этаноле, растворим в разбавленных неорганических кислотах, растворах едких и углекислых щелочей. Несовместим с новокаином, барбитуратами, ортоформом.
Норсульфазол обладает высокой антимикробной активностью в отношении стрептококков, менингококков, кишечной палочки, сальмонелл, пастерелл и других микроорганизмов. Это один из наиболее активных сульфаниламидных препаратов, но для создания бактериостатических концентраций его в крови требуются более высокие дозы. Токсичность норсульфазола выше, чем у стрептоцида, и может проявляться через 7—9 дн. после применения в форме гематурии и агранулоцитоза.
Препарат легко всасывается из желудочно-кишечного тракта и достигает максимальной концентрации в крови через 3—6 ч после введения. Терапевтическая концентрация удерживается в крови в течение 6—12 ч. Связывается с белками плазмы на 60—70 %, в результате чего затрудняется проникновение препарата в органы и ткани и замедляется его выведение. Ацетилируется незначительно и выделяется с мочой главным образом в свободной форме.
Норсульфазол применяют при катаральной бронхопневмонии, плевритах, стрептококковом и стафилококковом сепсисе, эндометритах, маститах, гастроэнтеритах, некробактериозе, диплококковой септицемии телят, пастереллезе птиц и других бактериальных инфекциях. Назначают внутрь 2—3 раза в сутки в следующих дозах: лошадям и крупному рогатому скоту 10—25 г, мелкому рогатому скоту и свиньям 2—5, курам 0,5 г. Начальная доза норсульфазола должна быть в 2 раза выше.
При катаральной бронхопневмонии телят норсульфазол применяют внутритрахеально в дозе 0,05 г/кг массы в форме 8-10%-ного раствора в течение 3—4 дн. Целесообразно одновременно назначать антибиотики. При диплококковой сепитцемии телят препарат вводят внутривенно по 0,01—0,02 г/кг массы.
При лечении ран норсульфазол используют в форме присыпок и мазей в различных комбинациях с пенициллином, грамицидином, йодом, а также другими сульфаниламидами. При этом необходимо очистить рану от гноя и некротизированных тканей.
Противопоказания к применению норсульфазола: нефриты, гепатиты, заболевания крови и кроветворной системы. В период назначения препарата прием воды не ограничивают.
Выпускают норсульфазол в порошке и таблетках по 0,25 и 0,5 г. Хранят с предосторожностью по списку Б в хорошо укупоренной таре. Срок проверочного анализа 5 лет.
Норсульфазол-натрий — Norsulfazolum - natrium. 2 - (пара -Аминобензолсульфамидо) - тиазол - натрий. Синонимы: норсульфазол растворимый, сульфатиазол - натрий.
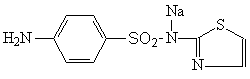
Пластинчатые, блестящие, бесцветные или со слегка желтоватым оттенком кристаллы без запаха. Легко растворим в воде (1 : 2). Водные растворы имеют сильно щелочную реакцию, выдерживают стерилизацию при 100 °С в течение 30 мин.
Препарат имеет такую же химиотерапевтическую активность, как и норсульфазол. Благодаря хорошей растворимости в воде его можно применять не только внутрь, но и парентерально, а также в виде глазных капель.
Показания к применению те же, что и для норсульфазола. Используют при септических процессах, когда необходимо быстро создать высокую концентрацию препарата в крови, например, при диплококковой септицемии телят, некробактериозе, колибактериозе и т. д. Назначают норсульфазол-натрий главным образом внутривенно в форме 5-15%-ных растворов вводят медленно. Под кожу и внутримышечно препарат можно вводить в растворах не выше 0,5—1 %-ной концентрации. Попадание под кожу более крепких растворов вызывает раздражение тканей, вплоть до некроза. Дозы внутривенно: лошадям 6—12 г, крупному рогатому скоту 6—10, овцам 1—2, собакам 0,5—1 г 2 раза в сутки в течение 3—4 дн.
При пастереллезе птиц норсульфазол-натрий применяют в форме 20 %-ной масляной суспензии или водного раствора. Суспензию вводят однократно в область верхней трети шеи курам и уткам по 1 мл на 1 кг массы птицы. Водный раствор готовят непосредственно перед применением из расчета 0,5 сухого вещества для кур и 1 г для индеек на прием. Препарат дают птице с кормом 2 раза в сутки. При кокцидиозе цыплят дают с питьевой водой в форме 0,25 %-го водного раствора.
При маститах пораженную долю вымени сдаивают и вводят 3, 5 или 10%-ный раствор норсульфазол - натрия через молочный катетер в объеме 25—40 мл. Сосок зажимают на 10—15 минут. Лечение проводят 1—2 раза в сутки до выздоровления.
При конъюнктивитах, блефаритах и других инфекционных, заболеваниях глаз применяют 10%-ные растворы в виде глазных капель 3—4 раза в день.
Противопоказания к применению норсульфазол - натрия болезни кроветворной системы, нефриты, нефрозы.
Выпускают в форме порошка. Хранят с предосторожностью по списку Б в упаковке, предохраняющей от действия влаги и света. Срок проверочного анализа 3 года.
Этазол — Aethazolum. 2-(пара-Аминобензолсульфамидо)-5-этил-1,3,4-тиадиазол. Синонимы: берлофен, глобуцид, сетадил, сульфаэтидиол и др.
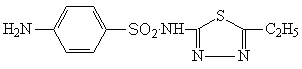
Белый или белый со слегка желтоватым оттенком порошок без запаха. Практически нерастворим в воде, трудно растворим в этаноле, мало растворим в разбавленных кислотах, легко растворим в растворах щелочей. Несовместим с пептоном, пара-аминобензойной кислотой, новокаином, барбитуратами, многими производными серы.
Этазол обладает высокой антимикробной активностью в отношении стрептококков, пневмококков, менингококков, патогенных анаэробов, кишечной палочки, возбудителей дизентерии, сальмонеллеза, пастереллеза и др. Этазол превосходит многие сульфаниламиды по антибактериальному действию против целого ряда микроорганизмов.
Препарат быстро всасывается из желудочно-кишечного тракта в кровь. Через 2—3 ч у собак и через 5—8 ч у крупного рогатого скота отмечают максимальную концентрацию в крови. Этазол относится к сульфаниламидным препаратам короткого действия, у которых максимальный уровень концентрации снижается на 50 % за 5—10 ч. Хорошо проникает через гематоэнцефалический барьер, распределяется в различных органах и тканях неравномерно: дольше всего задерживается в почках, желудочно-кишечном тракте, печени, легких. В организме собак препарат не ацетилируется, а у других животных подвергается ацетилированию в незначительной степени (5—10 %), поэтому его применение не приводит к образованию кристаллов в мочевых путях. Выделяется этазол наиболее быстро у собак, затем у кроликов и наиболее медленно — у крупного рогатого скота.
Применяют при бронхопневмонии, ангине, послеродовом сепсисе, эндометритах, дизентерии, диспепсии, роже свиней и других заболеваниях бактериальной этиологии, возбудители которых чувствительны к сульфаниламидам.
Дозы внутрь: лошадям 10—25 г, крупному рогатому скоту 15—25, мелкому рогатому скоту 2—3, свиньям 2—5, кроликам 1—1,5, птице 0,5, собакам 0,3—0,5 г 3—4 раза в сутки в течение 4—6 дн. подряд. При тяжелом течении болезни начальную дозу увеличивают вдвое. Дозы для молодняка составляют 2/3 от дозы для взрослого животного.
Для профилактики раневой инфекции этазол вводят в полость раны в форме пудры, 5 %-ной мази. Одновременно препарат назначают внутрь.
Противопоказания к применению: сильно выраженный ацидоз, острые гепатиты, гемолитическая анемия, агранулоцитоз.
Выпускают этазол в форме порошка и таблеток по 0,25 и 0,5 г. Хранят по списку Б в хорошо укупоренной таре. Срок проверочного анализа 3 года
Этазол-натрий — Aethazolum-natrium 2 (пара Аминобензол-сульфамидо) 5 Этил 1,3,4 тиадиазол натрий. Синонимы: этазол растворимый, сульфаэтидол натрий.
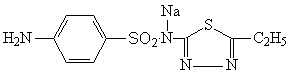
Белый кристаллический порошок. Легко растворим в воде; трудно растворим в этаноле. Водные растворы стабильны, можно стерилизовать кипячением в течение 30 мин. Несовместим к новокаином, анестезином, препаратами, легко отщепляющими серу.
Этазол-натрий легко всасывается при различных путях введения, быстро достигает максимального уровня концентрации в крови и активно проникает в различные органы и ткани. За счет хорошей растворимости в воде его можно применять не только внутрь, но внутримышечно и внутривенно. В организме циркулирует в основном в свободной форме, выделяется быстро.
Антибактериальная активность и показания к применению такие же, как и у этазола.
Применяют 10—20 %-ные растворы внутримышечно и внутривенно. Дозы: лошадям и крупному рогатому скоту 5—10 г, мелкому рогатому скоту 1—2, свиньям 2—3, собакам 0,1—0,3 г 2—3 раза в сутки.
Противопоказания к применению этазол-натрия те же, что и для этазола.
Этазол-натрий выпускают в порошке, а также в ампулах 3 в форме 10—20 %-ного раствора для инъекций.
Хранят с предосторожностью по списку Б в защищенном от света месте. Срок проверочного анализа 5 лет.
Сульфацил — Sulfacylum. пара-Аминобензолсульфацетамид. Синонимы: ацетоцид, ацетосульфамин, альбуцид, септурон, суламид, сульфацетамид и др.
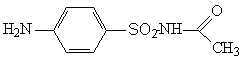
Белый или белый с желтоватым оттенком кристаллический порошок без запаха, растворимый в 20 частях холодной воды (в горячей воде растворяется значительно легче), в 12 частях этанола, в растворах щелочей и кислот. Несовместим с новокаином, анестезином, препаратами, отщепляющими серу.
Сульфацил обладает сильным антимикробным действием в отношении стрептококков, стафилококков, пневмококков, возбудителей сальмонеллеза и колибактериоза.
Препарат быстро всасывается из желудочно-кишечного тракта животных. Максимальная концентрация в крови устанавливается через 2—5 ч с момента введения. За 6-12 ч максимальная концентрация снижается на 50 %. Ацетилируется в умеренной степени (10-15%). Незначительно связывается с белками плазмы, хорошо проникает в различные органы и ткани. Сравнительно быстро выделяется из организма, главным образом с мочой.
Применяют при ангинах, фарингитах, бронхопневмониях, послеродовом сепсисе, стрептококковых инфекциях, колибактериозе, сальмонеллезе, диспепсии, циститах и т. п. Местно назначают в форме присыпок и мазей при лечении гнойных ран, кожных стрептококковых и стафилококковых заболеваний, конъюнктивитов Дозы внутрь: лошадям 5—10 г, мелкому рогатому скоту 2—3, свиньям 1—2, собакам 0,5—1 г 3—4 раза в сутки. Начальная доза должна быть в 2—3 раза больше последующих.
Противопоказания к применению — аналогичные другим сульфаниламидам.
Выпускают сульфацил в порошке. Хранят по списку Б в хорошо укупоренной таре, предохраняющей от действия света. Срок проверочного анализа 5 лет.
Сульфацил-натрий — Sulfacylum-natrium. пара-Аминобен-золсульфацетамид-натрий — натриевая соль сульфацила. Синонимы: сульфацил растворимый, сульфацетамид-натрий, альбуцид-натрий и др.
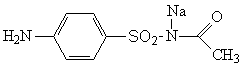
Белый кристаллический порошок без запаха. Легко растворим в воде, практически нерастворим в этаноле, эфире. Несовместимость — аналогично другим сульфаниламидам.
По антимикробному действию и особенностям фармакокинетики сходен с сульфацилом.
Применяют при пиелитах, циститах, колитах и послеродовом сепсисе. Назначают внутрь в дозах: лошадям и крупному рогатому скоту 3—10 г, мелкому рогатому скоту и свиньям 1—2, собакам 0,3—0,5 г 3—4 раза в сутки.
Наружно сульфацил-натрий применяют при лечении ран, язв роговицы, конъюнктивитов, маститов, эндометритов. Употребляют в форме присыпки, мази или растворов 10, 20 или 30 %-ной концентрации. Особенно хорошие результаты получены при применении сульфацил-натрия в глазной практике.
Противопоказания к применению: острый гепатит, агранулоцитоз, гемолитическая анемия.
Выпускают в порошке. Хранят по списку Б в упаковке, предохраняющей от действия света и влаги. Срок проверочного анализа 5 лет.
Сульфантрол — Sulfanthrolum. 2-(пара-Аминобензолсульфа-мидо)-бензоат, гидрат.
Белый или белый с желтоватым или розовым оттенком кристаллический порошок, хорошо растворим в воде (1 : 8), трудно растворим в этаноле. Водные растворы стойкие, их стерилизуют кипячением в течение 15 мин. Несовместим с препаратами, легко отщепляющими серу, новокаином, анестезином, барбитуратами.
Сульфантрол активен в отношении стрептококков, пневмококков и кишечной палочки. Препарат высоко токсичен для нутталий.
Применяют при нутталиозе и пироплазмозе лошадей, тейлериозе крупного рогатого скота, бронхопневмонии, сальмонеллезе, колибактериозе, гнильце пчел и других заболеваниях. При нутталиозе лошадей сульфантрол назначают внутривенно в форме 4 %-ного раствора в дозе 0,005—0,01 г чистого вещества на 1 кг массы животного. Препарат вводят 1—3 раза с интервалом 24—38 ч. При заболевании лошадей нутталиозом и пироплазмозом применяют смесь 4 %-ного раствора сульфантрола и 1 %-ного раствора трипанового синего. Вводят внутривенно в дозе 0,5 мл на 1 кг массы животного 1—2 раза с интервалом 24—48 ч.
При тейлериозе крупного рогатого скота сульфантрол назначают внутримышечно в форме 10 %-ного раствора из расчета 0,003 г на 1 кг массы животного.
При бронхопневмонии препарат вводят внутримышечно и внутривенно в дозе 0,008—0,01 г на 1 кг массы животного. При колибактериозе, сальмонеллезе и других желудочно-кишечных заболеваниях сульфантрол назначают внутрь в первый день 0,2 г, во второй — 0,15, в третий — 0,1 и в четвертый - 0,05 г на 1 кг массы животного в сутки. Суточную дозу дают 3—4 приема.
При гнильце пчел препарат добавляют к сахарному сиропу в дозе 2 г на 1 л сиропа и скармливают одной пчелиной семье.
Противопоказания к применению сульфантрола: агранулоцитоз, острый гепатит, нефриты и нефрозы
Выпускают в порошке. Хранят с предосторожностью по списку Б в хорошо укупоренной таре, предохраняющей от действия света и влаги. Срок проверочного анализа 8 лет.
Сульфадимезин — Sulfadimezinum. 2-(пара-Аминобензол-сульфамидо)-4,6-диметилпиримидин. Синонимы: диазил, диазол, диметазил, диметилсульфадиазин, диметилсульфапиримидин, суперсептил и др.
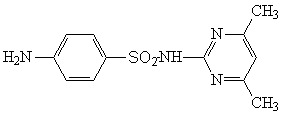
Белый или слегка желтоватый порошок без запаха. Практически нерастворим в воде, эфире и хлороформе, мало растворим в этаноле, легко растворим в разведенных минеральных кислотах и щелочах. Несовместим с новокаином, парааминобензойной кислотой, пептоном, барбитуратами.
Обладает широким антибактериальным спектром действия: активен по отношению к пневмококкам, стафилококкам, кишечной палочке, сальмонеллам, пастереллам, а также крупным вирусам. По активности близок к сульфазину и метилсульфазину. Действует бактериостатически, нарушает течение обменных процессов, тормозит рост и размножение микробов.
Сульфадимезин сравнительно быстро всасывается из желудочно-кишечного тракта. Максимальная концентрация препарата в крови устанавливается через 6—8 ч после введения. В крови животных он создает более высокие концентрации, чем любой другой. Из обычно применяемых сульфаниламидов, в такой же дозе. Препарат хорошо проникает через гематоэнцефалический барьер, создает высокие концентрации во многих органах и тканях. Связывается с белками на 75—85 %, ацетилируется в крови на 5—10%, моче — на 20—30%. Продукты ацетилирования сульфадимезина растворяются лучше, чем свободная форма препарата. Выделяется из организма медленно, главным образом почками. В связи с относительно небольшой скоростью элиминации он более безопасен по сравнению с норсульфазолом и другими быстро выделяющимися препаратами. Медленное выделение обеспечивает длительное (более 8 ч) поддержание терапевтического уровня в крови. Препарат хорошо переносят больные.
Сульфадимезин применяют при пневмониях, катаральной бронхопневмонии, бронхите, ларингите, ангине, мыте лошадей, сепсисах, эндометритах, инфекционных маститах, некробактериозе овец и северных оленей, диспепсии, гастроэнтеритах, инфекциях мочевых путей, сальмонеллезе, пастереллезе, респираторном микоплазмозе, кокцидиозе птицы и других заболеваниях. Назначают внутрь в дозах: лошадям 10—25 г, крупному рогатому скоту 15—20, мелкому рогатому скоту 2—3, свиньям 1—2, курам 0,3—0,5 г 1—2 раза в сутки. Начальную дозу необходимо увеличить в 2 раза
Для депонирования сульфадимезина его можно вводить свиньям, оленям, овцам под кожу или внутримышечно в форме 20 % ной суспензии на рыбьем жире, персиковом или рафинированном подсолнечном масле в дозе 1—1,2 мл на 1 кг массы животного. Одновременно назначают препарат внутрь в дозе 0,05 г на 1 кг массы.
При пастереллезе птицы сульфадимезин применяют с кормом из расчета 0,05 г на 1 кг массы животного 1—3 раза в день в течение 2—4 суток.
При лечении ран, язв, ожогов препарат употребляют наружно в форме мельчайшего порошка.
Противопоказания к применению сульфадимезина заболевания кроветворной системы, нефриты, нефрозы, гепатиты. При длительной терапии необходимо проводить исследования крови.
Сульфадимезин выпускают в порошке и таблетках по 0,25 и 0,5 г. Хранят по списку Б в защищенном от света месте в хорошо укупоренной таре. Срок проверочного анализа 10 лет.
Уросульфан — Urosulfanum. пара-Аминобензолсульфопил-мочевина. Синонимы: сульфакарбамид, сульфонилкарбамид, урамид и др.
Белый кристаллический порошок без запаха, кислого вкуса. Мало растворим в воде, трудно растворим в этаноле, легко растворим в разведенных кислотах и растворах едких щелочей. Несовместим с препаратами, отщепляющими серу, новокаином, анестезином, барбитуратами.
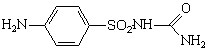
Уросульфан обладает высокой антибактериальной активностью по отношению к стафилококкам и кишечным палочкам.
0 комментариев