Навигация
2.6.2. Кругооборот кислорода
Один из наиболее сложных кругооборотов, так как с кислородом О2 вступает в реакцию большое количество органических и неорганических веществ, а также водород (последний дает с О2 воду Н2О). Упрощенная схема кругооборота кислорода представлена на рис. 2.8).
Кругооборот кислорода непосредственно связан с кругооборотом углерода (процессы фотосинтеза, дыхания и питания животных). Особенностью кругооборота кислорода является широкое многообразие кислородсодержащих веществ в биосфере. Кислород в
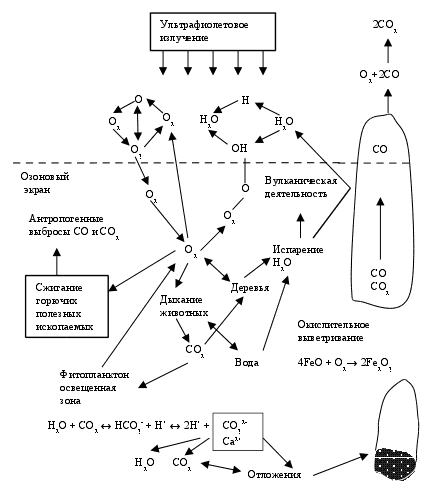
Рис. 2.8. Кругооборот кислорода
целом самый распространенный в биосфере химический элемент. В свободном виде (О2) он присутствует в наземных водных источниках, в почве и составляет основу воздуха, присутствуя в атмосфере также и в виде озона (главным образом в стратосфере). Роль озона в биосфере, его образование подробно рассматривается в других разделах пособия. В связанном виде кислород составляет основу горных пород и минералов (например, солевых и оксидных), а также газообразных продуктов (например, оксидов углерода, серы, азота и др.), и, наконец, воды (самого распространенного на планете вещества), образование которых рассматривается в других кругооборотах элементов и веществ.
Нарушение стабильного кругооборота кислорода происходит в основном из-за больших объемов сжигания органического топлива (свободный кислород тратиться на окисление), а с другой стороны, из-за массовой вырубки лесов (главного источника поступления свободного кислорода в биосферу). Одновременно с этим возникает целый блок глобальных проблем (парниковый эффект, кислотные дожди, явления "смога" и др.).
2.6.3. Кругооборот серы
Существуют гипотезы, что в ранние геологические эпохи Земли недостаток О2 предполагал существование серы в основном в виде Н2S и солей (главным образом, сульфидов, например FeS2). С формированием О2 начинаются окислительные процессы. В наше время сера на планете присутствует в виде Н2SО4 и Н2S (и их солей), и части свободной серы, SО2 , а также в виде органических веществ в живых организмах.
Величайшую роль в кругообороте выполняют бактерии. Мы уже знакомы с фотосинтезом, но, кроме этого, некоторые бактерии, используя энергию химических экзотермических реакций окисления (хемосинтез), синтезируют органические вещества. Так под действием особого вида бактерий (серобактерии) идет окисление Н2S до S:
2Н2S + О2 2Н2О + 2S + 127 ккал (+ Q).
Cера откладывается в «телах» серобактерий, составляя до 95 % их общей массы, тем самым устраняя вредное действие Н2S на растения и животных. Это неполный процесс окисления серы, он идет и дальше до Н2SО4 под действием О2 воздуха, а также пурпурных бактерий, для которых дыхание заменяется процессом:
бактерии
Н2S + 2О2 Н2SО4 + 189 ккал.
Сера окисляется на воздухе, а также в организмах серобактерий, если они будут лишены сероводородной среды:
2S + 3О2 + 2Н2О = 2Н2SО4 + 251 ккал,
SО2 или Н2SО3 – практически не образуются, а образуется Н2SО4, так как протекают достаточно сложные процессы:
2S + 2О2 + 2Н2О = 2Н2SО3 + 157 ккал, (1)
2Н2SО3 + Н2О + O2 = 2Н2SО4 + 94 ккал. (2)
Вторая реакция протекает быстрее, поэтому Н2SО3 (или же SО2 + Н2О) не накапливается. Свободная Н2SО4 в природе встречается редко (разве что при кислотных дождях), она очень активна, поэтому реагирует с содержащимися в почве и воде веществами или горными породами, например:
СаСО3 + Н2SО4 = СаSО4 + СО2 + 2Н2О.
Большая часть сульфатов уносится водами рек, а также под действием осадков и выветривания минералов, в моря, частью растворяясь в океанических водах, а частью откладываясь на дне в виде напластований и образуя минералы, особенно природного гипса СаSО42Н2О, перемещаясь в глубины литосферы, а затем через годы – на поверхность и т.д.
Попадая в глубокие слои литосферы, тот же СаSО4, претерпевает восстановительный процесс, например, с участием органических веществ:
СаSО4 + СН4 СаS + СО2 + 2Н2О СаСО3 + Н2S + Н2О.
Таким образом, возникают сероводородные («серные») источники (например, Мацеста, Пятигорск). Но существуют и другие бактерии – сульфатовосстанавливающие, которые питаются за счет сульфатов. Так, на глубине ниже 150 м, например, в Черном море, сульфаты под действием этих бактерий восстанавливаются до сероводорода, который, поднимаясь наверх, вновь подвергается действию серобактерий, окисляется до SО42-, а часть Н2S уходит в атмосферу. Источники Н2S – болота, вулканическая деятельность, природные процессы гниения отмерших живых организмов.
При извержении вулканов выделяется Н2S и SО2, концентрации которых могут быть различными, тогда возможно протекание реакции: 2Н2S + SО2 3S + 2Н2О.
При избытке Н2S, выделяющаяся сера защищается от окисления и потому может образовывать на некоторой глубине в толще литосферы – пласты S или вкрапления.
Кроме того, на больших глубинах формируются горючие природные ископаемые (тот же уголь, и углеводороды, содержащие серу), откладываются сланцы и другие осадочные породы, содержащие серу.
При добыче этих ископаемых, их сжигании или химической переработке, а также их естественном разложении в атмосферу выбрасываются SО2 и Н2S, которые окисляются до Н2SО4 и, наряду с природными источниками, затем выпадают на землю в виде осадков – кислотных дождей. И так, круг замыкается. Особенно из-за деятельности человека, а также из-за окислительной способности воздуха в наше время кругооборот осуществляется с увеличением содержания сульфатов, а в прошлом – преобладали сульфиды.
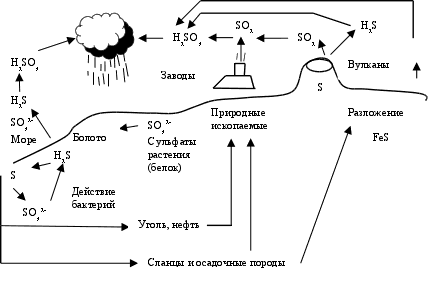
Остался неучтенным процесс потребления серы растениями, с учетом которого кругооборот серы можно выразить упрощенной схемой (рис. 2.9).
Переработка сульфатов растениями, в том числе и с использованием бактерий, очень сложный процесс, приводящий к синтезу растениями серосодержащих белковых веществ.
Животные, питающиеся растениями, также путем биохимических процессов синтезируют серосодержащие вещества, характерные для своих организмов. При отмирании животных и растений, их белковые вещества разлагаются до Н2S и некоторых других серосодержащих продуктов, и кругооборот серы продолжается.

Рис. 2.9. Кругооборот серы (упрощенно)
Кругооборот серы можно представить схемой (рис. 2.10).
H2SO4
Рис. 2.10. Кругооборот серы
Похожие работы
... друг друга, поэтому функционально схожие сообщества могут иметь различный видовой состав. Сообщества постоянно меняют свой внешний облик (лес весеннее – летнее - зимний периоды). Влияние той или иной популяции в биоценозе простирается до отдаленных его частей через конкурентов, хищников и жертв. Например, насекомоядные птицы, поедая насекомых опылителей, влияют косвенно на количество плодов.
... . М., НОРМА,2003. 10. Теория государства и права. Учебник./ Под ред. В.М. Корельского, В.Д.Перевалова. М., НОРМА, 2001. 11. Теория государства и права. Курс лекций./ Под ред. М.Н.Марченко. М., Зерцало, 1998. 12.Правоведение. Учебник./ Под ред О.Е.Кутафина. М., Юристъ,2001. 13.Варывдин В.А. Право.Курс лекций. М.,1999. ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА 14. Козлова Е.Н., ...
... на основе их анализа формулируются некие теоретические обобщения - гипотезы, а затем концепции и теории. Сразу надо сказать, что большая часть проблем в исторической экологии еще находится на стадии накопления и первичного обобщения фактов, идет лишь поиск путей решения некоторых задач, а во многих областях еще и сами задачи лишь формулируются. Оправданием служит тот факт, что работаем мы в очень ...
... В.Эдвардса, философа О.Конта и биолога И.И.Мечникова было положено начало экологии человека. Социальные аспекты экологии человека отражены в трудах О.Конта, Д.Милля и Г.Спенсера, а также американских социологов Р.Парка и Б.Берджеса. Важные наблюдения, оказавшие влияние на развитие экологии, были выполнены учеными Российской Академии наук в ходе экспедиционных исследований, проводимых со второй ...

0 комментариев