Навигация
Вплив структури кислотного реагенту на швидкість ацидолізу епіхлоргідрину
3.3 Вплив структури кислотного реагенту на швидкість ацидолізу епіхлоргідрину
Для оцінки впливу структури кислотного реагенту було проварійовано природу замісника в аліфатичних монокарбонових кислотах (табл. 3.9).
Таблиця 3.9 - Залежність спостерігаємої константи швидкості ацидолызу ЕХГ в присутності N,N-диметиланіліну від константи замісника σ* в карбоновій кислоті
| Кислота | σ* | kсп·107, с-1 | pKa |
| (СН3)3ССООН СН3СН(СН3)СООН СН3СН2СООН СН3СООН Ph-CH2COOH Et-O-CH2COOH Ph-O-CH2COOH | -0,30 -0,19 -0,10 0 0,215 0,65 0,85 | 8,75±0,18 6,50±0,01 5,63±0,12 4,20±0,11 5,71±0,08 6,03±0,04 8,08±0,04 | 5,03 4,85 4,87 4,75 4,31 3,55 3,17 |
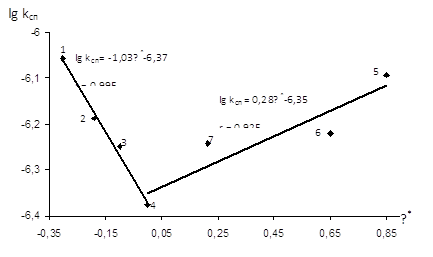
Рис.3.10 Залежність lgkсп від σ* замісника в оцтовій кислоті (0,181 – 0,233 М) при ацидолізі ЕХГ (12,35 – 12,53 М) у присутності C6H5N(CH3)2 (m=0,005 М) при Т=333К 1- (СН3)3ССООН; 2- СН3СН(СН3)СООН; 3- СН3СН2СООН; 4-CH3COOH; 5- Ph-O-CH2COOH; 6 – Et-O-CH2COOH; 7 - Ph-CH2COOH
Прямолінійна залежність у координатах lg kсп від σ* у випадку похідних оцтової кислоти з електронодонорними замісниками показує, що із збільшенням кислотних властивостей –ОН реагенту швидкість реакції зменшується, а отриманий коефіцієнт ρ1*=-1,03 вказує на збільшення швидкості реакції ацидолізу епіхлоргідрину із підвищенням донорних властивостей замісника в оцтовій кислоті, тобто із збільшенням ефективного негативного заряду на атомі кисню карбоксильної групи.
У випадку електроноакцепторних замісників в оцтовій кислоті також спостерігається прямолінійна залежність у координатах lg kсп ─ σ*, а коефіцієнт ρ2*=0,28, який вказує на збільшення швидкості реакції із збільшенням кислотних властивостей карбонової кислоти.
З наведених значень ρ1* та ρ2* видно, що чутливість реакційної серії до зміни електронодонорного замісника є значно вищою, ніж чутливість до зміни замісника електроноакцепторного характеру.
Для оцінки впливу сили кислотного реагенту на швидкість ацидолізу епіхлоргідрину була також побудована залежність у координатах lg kсп ─ рКа кислоти (рКа=3,17 ─ 5,03):
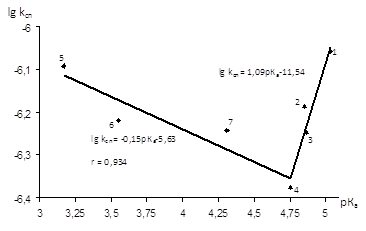
Рис.3.11 Залежність lgkсп від рКа кислоти при ацидолізі ЕХГ у присутності C6H5N(CH3)2 (m=0.005 М) при Т=333К 1- (СН3)3ССООН; 2- СН3СН(СН3)СООН; 3- СН3СН2СООН; 4-CH3COOH; 5- Ph-O-CH2COOH; 6 – Et-O-CH2COOH; 7 - Ph-CH2COOH
Як і у випадку залежності Тафта, залежність Бренстеда носить V-подібний характер, але з гіршим коефіцієнтом кореляції. Коефіцієнт β=1,09±0,24 у випадку кислот з електронодонорними замісниками вказує на чутливість реакції до зміни сили кислоти з рКа=4,75 ─ 5,03.
У випадку ж кислот із замісниками електроноакцепторної природи спостерігається дуже низька чутливість реакції ( β=-0,15±0,04) до сили кислот з рКа=4,75 ─ 3,17.
Таким чином, такий вид ламаної прямої можна пояснити зміною швидкістьвизначаючої стадії при переході від електронодонорної до електроноакцепторної природи замісника в молекулі оцтової кислоти в рамках єдиного механізму реакції.
0 комментариев