Навигация
Вплив концентрації каталізатору на швидкість реакції
1.5 Вплив концентрації каталізатору на швидкість реакції
Для вивчення впливу концентрації каталізатору на швидкість реакції були досліджені кінетичні закономірності реакції оксиетилювання оцтової кислоти при каталізі ацетатами Li+, Na+, K+, Cr3+, [(Me)4N]+, [(Et)4N]+, [(Bu)4N]+. Експерименти були проведені при різних концентраціях солей, що вивчали при 900С [9] (табл. 1.4).
Таблиця 1.4 - Залежність спостерігаємої константи швидкості від концентрації каталізатора [9]
| Скат, моль/л | САсОН, моль/л | kсп·104, с-1 | Скат, моль/л | САсОН, моль/л | kсп·104, с-1 |
| CH3COOLi | (CH3COO)3Cr | ||||
| 0.0980 0.1580 0.1920 0.2530 0.3546 | 16.02 16.00 15.90 15.88 15.82 | 3.28 4.27 5.33 6.48 8.73 | 0.0010 0.00295 0.00548 0.00842 0.0100 | 16.20 16.20 16.10 16.10 16.00 | 2.99 5.51 7.28 9.59 10.67 |
| CH3COONa | (Me)4N+CH3COO– | ||||
| 0.0530 0.0840 0.1140 0.1550 0.1940 | 16.10 16.16 16.08 15.96 16.00 | 2.80 3.27 4.30 5.37 6.83 | 0.0710 0.0918 0.1508 0.2016 | 15.83 15.65 15.56 15.44 | 6.13 8.33 12.40 15.67 |
| CH3COOK | (Et)4N+CH3COO– | ||||
| 0.1000 0.1450 0.2030 0.2480 | 15.88 15.68 15.80 15.78 | 4.58 5.95 7.57 9.80 | 0.0138 0.0750 0.1235 | 15.84 15.81 15.83 | 2.18 7.29 11.38 |
| (Bu)4N+CH3COO– | |||||
| 0.0120 0.0564 0.0998 | 15.81 15.79 15.78 | 2.27 6.83 11.30 | |||
Як видно з експериментальних даних, досліджувані солі прискорюють реакцію прямопропорційно їх концентрації у реакційній масі [9].
При екстраполюванні експериментальних значень спостережених констант швидкостей до нульової концентрації каталізатору для всіх досліджуваних солей одержано одне і те ж значення, яке відповідає константі швидкості некаталітичної реакції, що узгоджується з даними [9] про паралельне протікання двох реакцій оксиду етилену – каталітичної (з участю солі) та некаталітичної [9].
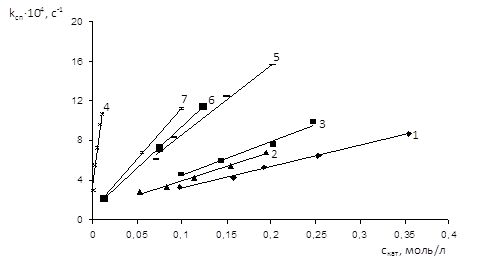
Рис. 1.3 Залежність спостереженої константи швидкості від концентрації каталізатора при 900С: 1 - CH3COOLi; 2 - CH3COONa; 3 - CH3COOK; 4 - (CH3COO)3Cr; 5 - (Me)4N+CH3COO– ; 6 - (Et)4N+CH3COO– [9]
Отримані залежності описуються рівнянням:
kсп = kн + kкат·скат (1.2), де
kн – константа швидкості некаталітичної реакції, с-1; kкат - константа швидкості каталітичної реакції, л/(моль·с) [9].
Для встановлення порядку реакції за каталізатором було досліджено кінетику реакції оцтової, акрилової та метакрилової кислот з 1,2-епоксі-3-феноксіпропаном, яка каталізується ацетатом хрому (ІІІ) при 700С. Концентрація каталізатору варіювалася у межах від 0.002 до 0.008 моль/л (у випадку акрилової та метакрилової кислот) та від 0.008 до 0.015 моль/л (у випадку оцтової кислоти) [8].
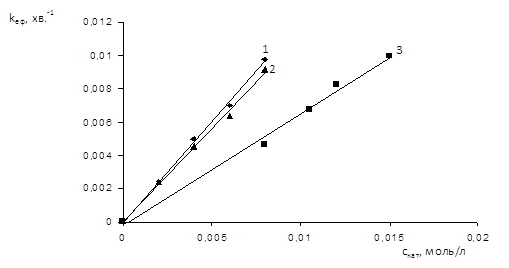
Рис. 1.4 Залежність ефективної константи швидкості карбонової кислоти від концентрації каталізатору при Т=700С: 1 – CH2=CH─COOH; 2 – CH2=C(CH3)─COOH; 3 – CH3COOH [8]
Наведена вище графічна залежність у всіх випадках носить прямолінійний характер, що свідчить про перший порядок реакції за каталізатором [8].
0 комментариев