Навигация
Напрямок розкриття α-оксидного кільця в реакції епіхлоргідрину з карбоновими кислотами при основному каталізі
1.3 Напрямок розкриття α-оксидного кільця в реакції епіхлоргідрину з карбоновими кислотами при основному каталізі
Для дослідження напрямку розкриття α-оксидного кільця епіхлоргідрину масляною, півалевою (триметилоцтовою) та бензойною кислотами у присутності ряду основних каталізаторів були використані методи газо-рідинної хроматографії (ГРХ) та протонного магнітного резонансу (ПМР). Реакцію проводили у двократному надлишку епіхлоргідрину при температурі 80 – 1100С. У якості каталізаторів використовували триетиламін, тетраетиламоній йодид, гідроксид, хлорид та гідроортофосфат натрію у кількості 0,05 моль на 1 моль кислоти [6].
Методами елементного та функційного аналізу, а також ІЧ спектроскопії встановлено, що основним продуктом реакції (вихід 80 - 97%) є хлоргідриновий ефір карбонової кислоти [6].
Продукти реакції були досліджені методом ГРХ.
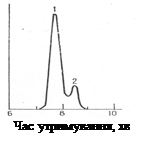
Рис. 1.1 Хроматограма суміші хлоргідринових ефірів масляної кислоти: 1 - 1,2-хлоргідриновий ефір; 2 - 1,3-хлоргідриновий ефір [6]
З рис. 1.1 видно, що хлоргідриновому ефіру відповідають два неповністю розділених піки, тобто у його складі наявні два ізомери, які неможливо розділити перегонкою [6].
Для підтвердження утворення аномального ізомеру було використано спектроскопію ПМР.
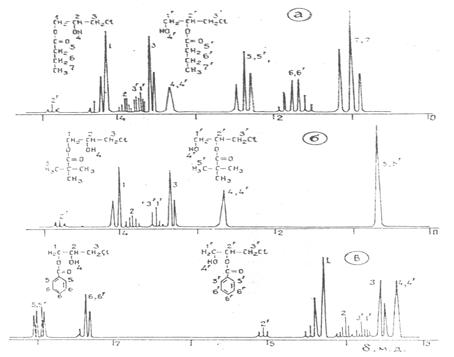
Рис. 1.2 ПМР спектри хлоргідринових ефірів масляної (а), півалевої (б), та бензойної (в) кислот [6]
Наявність резонансу метинового протону в області 5,2 – 4,9 м.д., обумовленого складноефірною групою, свідчить про присутність 1,3 – хлоргіринового ефіру. Кількість ізомеру, яка визначена методами ГРХ та ПМР, співпадає та складає 15 - 20% [6].
У табл. 1.2 наведені дані про ізомерний склад хлоргідринових ефірів, які отримані у різних умовах.
Таблиця 1.2 - Ізомерний склад хлоргідринових ефірів карбонових кислот в реакції ЕХГ з масляною, півалевою та бензойною кислотами в присутності каталізаторів основної природи [6]
| Каталізатор | t, 0С | Кислота | Вміст 1,3-ХГЕ, % (за даними ГРХ) |
| NaOH (C2H5)4NJ (C2H5)3N Na2HPO4 NaCl NaOH NaOH NaOH (C2H5)4NJ (C2H5)4NJ (C2H5)4NJ (C2H5)4NJ | 80 80 80 80 80 80 90 100 80 90 100 110 | CH3CH2CH2COOH CH3CH2CH2COOH CH3CH2CH2COOH CH3CH2CH2COOH CH3CH2CH2COOH (CH3)3CCOOH (CH3)3CCOOH (CH3)3CCOOH (CH3)3CCOOH (CH3)3CCOOH (CH3)3CCOOH (CH3)3CCOOH | 21.9 18.1 17.1 15.1 14.7 15.3 17.5 18.3 18.0 17.8 18.0 18.0 |
З табл. 1.2 випливає, що зміна умов проведення реакції (природа каталізатора та температура) мало впливають на ізомерний склад продуктів взаємодії епіхлоргідрину з карбоновими кислотами [6].
1.4 Вплив структури кислотного реагенту на швидкість реакції
Для вивчення впливу структури кислотного реагенту на швидкість реакції було досліджено кінетику реакції оцтової, акрилової та метакриловлї кислот з 1,2-епоксі-3-феноксіпропаном у присутності ацетату хрому (ІІІ) як каталізатора при температурі 600С [8]. Результати наведені в табл. 1.3.
Таблиця 1.3 - Константи швидкості реакції деяких карбонових кислот з 1,2-епоксі-3-феноксіпропаном у присутності ацетату хрому (ІІІ) [8]
| Кислота | Т, 0С | k2·102, л/моль·с |
| Оцтова Акрилова Метакрилова | 60 60 60 | 0.552±0.030 1.075±0.055 1.068±0.022 |
З наведених величин констант швидкості таблиці 1.3 видно, що найшвидше з 1,2-епоксі-3-феноксіпропаном реагує акрилова кислота за даних умов проведення експерименту у той час як оцтова кислота – найповільніше [8].
У реакції перелічених вище кислот з епіхлоргідрином спостерігалася аналогічна залежність: швидкість реакції збільшувалася у ряду:
оцтова кислота < метакрилова кислота < акрилова кислота,
причому константи швидкості реакції з акриловою та метакриловою кислотами мало відрізнялися як і у випадку реакції цих кислот з 1,2-епоксі-3-феноксіпропаном [8].
Це пояснюють стеричним ефектом наведених кислот: найбільш об’ємна молекула метакрилової кислоти реагує важче з більш заміщеним атомом карбону 1,2-епоксі-3-феноксіпропана, ніж менш об’ємна молекула акрилової кислоти, не дивлячись на більш високу загальну швидкість взаємодії останнього [8].
Виходячи з експериментально отриманих величин констант швидкостей даних карбонових кислот, були розраховані величини ![]() реакції карбонових кислот з 1,2-епоксі-3-феноксіпропаном, де
реакції карбонових кислот з 1,2-епоксі-3-феноксіпропаном, де ![]() - константи швидкості акрилової та метакрилової кислот;
- константи швидкості акрилової та метакрилової кислот; ![]() - константа швидкості оцтової кислоти. Ці величини набули значення 1.95 та 1.93 для акрилової та метакрилової кислот відповідно. Отже, за цими розрахунками встановлено, що при 600С ненасичені кислоти мають подібну реакційну здатність [8].
- константа швидкості оцтової кислоти. Ці величини набули значення 1.95 та 1.93 для акрилової та метакрилової кислот відповідно. Отже, за цими розрахунками встановлено, що при 600С ненасичені кислоти мають подібну реакційну здатність [8].
0 комментариев