Навигация
Методика кінетичних вимірювань
2.2 Методика кінетичних вимірювань
Необхідні розчини реагентів готують за точною наважкою речовин. Точну концентрацію кислотного реагенту встановлюють за допомогою кислотно-основного потенціометричного титрування.
До однієї частини кінетичної колби вносять 2 мл розчину карбонової кислоти в епіхлоргідрині, а до другої – 1 мл розчину каталізатору в епіхлоргідрині. Колбу термостатують протягом 10 хвилин, а потім змішують розчини з обох частин кінетичної колби, точно відмічаючи при цьому час початку реакції. Через заданий проміжок часу реакцію припиняють шляхом доливання до реакційної суміші 15 мл охолодженої суміші ізопропілового спирту та води (1: 1) при швидкому змішуванні.
Вміст колби кількісно переносять водою до стакану для титрування та титрують лугом (NaOH), визначаючи поточну концентрацію кислоти.
Кількість кислоти, що не прореагувала, розраховують за рівнянням:
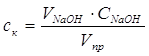 (2.1),
(2.1),
де ![]() - концентрація карбонової кислоти, моль/л;
- концентрація карбонової кислоти, моль/л;
![]() - об’єм розчину NaOH, який має концентрацію
- об’єм розчину NaOH, який має концентрацію ![]() , що пішов на титрування, мл;
, що пішов на титрування, мл;
![]() - - об’єм проби реакційної суміші, мл.
- - об’єм проби реакційної суміші, мл.
2.3 Математична обробка експериментальних даних
Константи швидкості, які ми спостерігаємо, були розраховані за рівнянням нульового та першого порядків, виходячи з припущення, що реакція має нульовий порядок за кислотою, за формулами [17,18]:
для n=0 ![]() (2.2)
(2.2)
для n=1 ![]() (2.3)
(2.3)
де а – вихідна концентрація карбонової кислоти, моль/л;
(а-х) – поточна концентрація карбонової кислоти, моль/л;
t – час перебігу реакції, с;
b – вихідна концентрація епіхлоргідрина, моль/л;
Реакцію проводили в умовах псевдопорядку 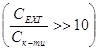 , що дозволяє знехтувати зміною концентрації епіхлоргідрину.
, що дозволяє знехтувати зміною концентрації епіхлоргідрину.
Для статистичної оцінки констант швидкості використовували формулу [18]:
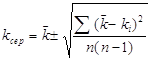 (2.4),
(2.4),
де ![]() - середньоквадратична константа швидкості, с-1;
- середньоквадратична константа швидкості, с-1;
![]() - середньоарифметична константа швидкості, с-1;
- середньоарифметична константа швидкості, с-1;
![]() - і-те значення константи швидкості, с-1;
- і-те значення константи швидкості, с-1;
![]() - кількість дослідів.
- кількість дослідів.
Енергія активації Еа була розрахована за формулою [17]:
![]() (2.5),
(2.5),
де R - універсальна газова стала;
T1, T2 - температура проведення реакції, К (Т2>Т1);
kТ1, kT2 - костанти швидкості реакції при температурах Т1 та Т2 відновідно.
Передекспонентний множник А визначається з рівняння Ареніуса [17]:
![]() (2.6)
(2.6)
Ентальпію активації DHТ# розраховували за формулою [17]:
DHТ# = Ea-n×R×T (2.7),
деn - молекулярність реакції;
Ентропія активації DSТ# була розрахована за формулою [17]:
DSТ# = R×(ln A - ln T - 25,76) (2.8)
За правилом Вант-Гофа визначається температурний коефіцієнт γ [17]:
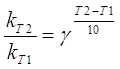 (2.9)
(2.9)
Експериментальні дані були оброблені за рівняннями (2.2) – (2.9) з використанням сучасних комп’ютерних програм.
2.4 Техніка безпеки
Багато з органічних та неорганічних речовин, що використовуються в роботі, здійснюють шкідливий вплив на організм людини. Для безпечного використання роботи треба додержуватись правил техніки безпеки [19].
2.4.1 Робота з епіхлоргідрином [19]
Епіхлоргідрин – високотоксична речовина, яка має сильну подразнюючу дію. Проникаючи крізь дихальні шляхи та шкіру, викликає шкіряні захворювання. Всі роботи з епіхлоргідрином слід проводити в гумових рукавичках, у витяжній шафі.
При попаданні епіхлоргідрина на шкіру слід змити теплою водою з милом та протерти спиртом.
2.4.2 Робота з оцтовою кислотою [19]
Оцтова кислота подразнює шкіру, а також слизові оболонки дихальних шляхів. Пари викликають кашель та нежить, іноді тошноту та блювання. Роботу проводять у витяжній шафі.
2.4.3 Робота з амінами [19]
Токсична дія N,N-диметиланілінів подібнодо аніліну, але слабкіше. У легких випадках — синюха, невелика слабість, розбитість, головний біль, поганий апетит. Усі роботи з ними необхідно проводити у гумових рукавичках, нарукавниках, фартухах, чоботах, у костюмах з бавовняної тканини.
0 комментариев