Навигация
Вплив структури каталізатору на швидкість реакції
1.6 Вплив структури каталізатору на швидкість реакції
Для вивчення впливу структури каталізатору була вивчена реакція оцтової, акрилової та метакрилової кислот з 1,2-епоксі-3-феноксіпропаном у присутності ряду метилзаміщених похідних піридину [8]. Збільшення швидкості реакції спостерігалося, коли піридин був заміщений метильним радикалом у третьому або четвертому положеннях, у той самий час, коли α-піколін (2-метилпіридин) виявився менш активним каталізатором, ніж незаміщений піридин. Подібна залежність каталітичної активності від структури каталізатору була виявлена для метилпохідних хіноліну [8].
При вивченні кінетичних закономірностей цієї реакції у присутності третинних амінів була виявлена залежність каталітичної активності від розміру катіона активної форми каталізатора. На основі отриманих експериментальних даних було встановлено, що із збільшенням радіусу катіона електростатична взаємодія між іонами ставала слабшою, нуклеофільність карбоксилат-аніону збільшувалася і збільшувалася каталітична активність. Такий взаємозв’язок був отриманий для реакції карбонових кислот з 1,2-епоксіпропаном та 1-хлор-2,3-епоксіпропаном. Однак, стеричні фактори можуть змінювати таку закономірність. Зменшення швидкості реакції спостерігалося для катіонів "великого розміру" у випадку 2-метилпіридину та 2-метилхіноліну [8].
1.7 Каталіз реакції фенілгліцидилового ефіру з карбоновими кислотами у присутності каталізатору N,N-диметиланіліну
Для пояснення прискорюючої дії жирноароматичних третинних амінів були запропоновані механізми загального основного та нуклеофільного каталізів реакції фенілгліцидилового ефіру з оцтовою та бензойною кислотами у присутності каталізатору N,N-диметиланіліну (ДМА), де амін виступає у ролі основи (реакція 1.1) або у ролі нуклеофіла (реакція 1.2) [9]:
![]() R3N + R’COOH
R3N + R’COOH ![]() R3N
R3N![]() HOOCR’
HOOCR’![]() [R3NH]+R’COO─ (1.1)
[R3NH]+R’COO─ (1.1)
R3N + R’COOH + R’’─ ![]() [R3N─CH2─CH2R’’(OH)]+R’COO─ (1.2)
[R3N─CH2─CH2R’’(OH)]+R’COO─ (1.2)
Як було встановлено, каталітична активність жирноароматичних та аліфатичних третинних амінів дуже близька. Однак реалізація загального основного механізму каталіза жирноароматичними амінами (реакція 1.1) неможлива через їхню малу спроможність до протеолітичної взаємодії з карбоновими кислотами. Малоймовірна і реакція нуклеофільного механізму каталіза (реакція 1.2) через дезактивації неподільної пари електронів атома азота рπ-супрядженням. Останнє підтверджується даними про продукти реакції (табл. 1.5).
Таблиця 1.5 - Елементний склад хлоридів, виділених із реакційної суміші, а також речовин порівняння [9]
| Склад вихідної реакційної суміші, моль/л | Елементний склад продуктів, % | |||||
| ФГЕ | СН3СООН | ДМА | С | Н | N | Cl |
| 3,0 0,8 | 2,0 4,5 | 0,7 0,12 | 63,0 59,9 | 6,93 7,45 | 5,92 6,79 | 15,4 18,7 |
| Речовини порівняння (розраховано): | ||||||
| [(CH3)2C6H5NCH2─CH(OH)─CH2─OC6H5]Cl (CH3)2C6H5N·HCl | 66,2 60,7 | 7,46 7,69 | 4,55 8,85 | 11,5 22,4 | ||
У той же час карбоксилат-аніони можуть утворюватися при взаємодії аміна та кислоти через утворення комплексу з переносом заряду (КПЗ), при розпаді якого утворюються радикали та іони (реакція 1.3):
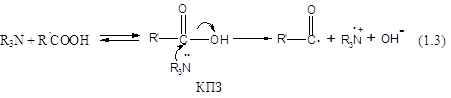
Для підтвердження утворення радикальних сполук, які свідчать про появу КПЗ (реакція 1.3), у реакційну суміш ФГЕ – С6Н5СООН – ДМА був введений метилметакрилат [9]. В умовах досліду був отриманий полімер, що відповідав структурі поліметилметакрилату. "Холостий" дослід показав, що у використаних умовах при відсутності кислоти ДМА полімеризацію метилметакрилату не викликає.
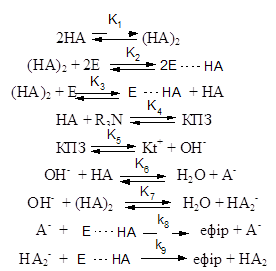
Отримані дані дозволили запропонувати схему протікання реакції α-оксиду з кислотою через стадію утворення КПЗ з урахуванням асоціативних взаємодій різного виду (НА – карбонова кислота, Е – епоксидна сполука):
0 комментариев