Навигация
Твёрдые оксидные электролиты
4. Твёрдые оксидные электролиты
4.1 Общие сведенья
Жидкие электролиты — водные растворы, или расплавы, солей, кислот и оснований — известны давно. Они работают в аккумуляторах и "сухих" батарейках, применяются для получения и очистки металлов, щелочей, органических соединений, для никелирования и анодирования. Свойства жидких электролитов знакомы многим — их изучают даже в школе. Но есть ещё один класс подобных веществ так называемые твёрдые электролиты. В 1820 году Ханс Кристиан Эрстед обнаружил магнитное действие электрического тока. На рисунке Р. Шторха виден гальванический элемент того времени: пара электродов из разных металлов, погруженных в жидкий электролит — раствор кислоты или щёлочи. Сегодня наиболее перспективными считаются устройства, работающие на твёрдых оксидных электролитах — материалах, изучение которых началось совсем недавно. Знают о них в основном только специалисты-химики, история их изучения коротка, широкое применение только начинается. Твёрдые электролиты связывают в основном с надеждой создать лёгкий и ёмкий аккумулятор для электромобиля. Сегодня аккумулятор массой 50–60 килограммов способен запасти гораздо меньше энергии, чем её "хранится" в бензобаке. Источник тока на твёрдом электролите, над созданием которого работают ведущие компании мира, по удельной энергоёмкости обещает сравняться с топливом.
Спектр применения твёрдых электролитов очень широк. На их основе можно делать "вечные" печи и источники света, анализаторы газов, устройства для получения чистого кислорода, генераторы электричества и многое другое. Будущее твёрдых электролитов представляется весьма многообещающим, поэтому знать о них следует.
4.2 Электролиты
В конце прошлого века Вальтер Нернст, известный немецкий исследователь, много сделавший для развития электрохимии, использовал в осветительных лампах спресованную смесь оксидов циркония и кальция. Электрический ток, проходя через стерженёк из этой "массы Нернста", нагревал его до белого каления. Так нашёл своё первое практическое применение твёрдый электролит.
Как известно, в металлах электрический ток создают покинувшие свои атомы, то есть свободные, электроны. В электролитах это делают другие заряженные частицы — ионы — целые атомы с недостающими электронами (положительные ионы, катионы) или с лишними (отрицательные ионы, анионы).
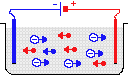
Растворы кислот, щелочей и солей образуют электролит — смесь положительных катионов (чёрные кружки) и отрицательных анионов (белые). Если в раствор опустить пару электродов, подключенных к источнику постоянного напряжения, катионы начнут двигаться к отрицательному электроду, анионы — к положительному. Через электролит пойдёт электрический ток, обусловленный движением зарядов разных знаков.
Если в жидкий электролит погрузить два электрода и приложить напряжение, то в электролите возникнет ток, направленное движение ионов: катионы пойдут к отрицательному ("–") электроду, к катоду; анионы — к положительному ("+"), к аноду.
Возможен и обратный процесс: если погрузить в жидкий электролит два электрода из определённым образом подобранных металлов, то на одном из них в результате химических реакций появится избыток электронов ("–"), а на другом — недостаток ("+"). Между электродами будет действовать электродвижущая сила, и, значит, вся система электроды–электролит превратится в химический генератор электрического тока. Так работал первый химический источник тока — гальванический элемент из медной и цинковой пластин, погружённых в раствор поваренной соли или серной кислоты. Так работают все нынешние гальванические элементы, батарейки и аккумуляторы.
В принципе то же самое происходит в химических электрогенераторах с твёрдыми электролитами.
4.3 Особенности твёрдых электролитов
Твёрдых электролитов известно великое множество — это оксиды, соли, кислоты и даже полимеры. В твёрдых растворах оксидов металлов разной валентности ток создаётся отрицательными ионами (анионами) кислорода.
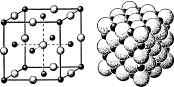
Модель типичного ионного кристалла — знакомой всем поваренной соли NaCl (А). Её кубическую решётку образуют две кубические же подрешётки, сдвинутые одна относительно другой на половину длины ребра куба. В узлах одной находятся катионы натрия Na+ (чёрные шарики), в узлах другой — анионы хлора Cl– (белые). Если же в модели соблюсти точный масштаб, станет видно, что ионы в решётке упакованы очень плотно (Б), и для наглядности кристаллическую структуру нередко рисуют двумерной.
Большинство этих твёрдых растворов — ионные кристаллы: в узлах кристаллической решётки находятся не нейтральные атомы, а заряженные ионы. Они образуют две подрешётки — катионную и анионную. Ионы совершают колебательные движения, но перемещаться по кристаллу, как в жидкости, не могут. Как же тогда в твёрдых электролитах возникает ток — движение заряженных частиц?
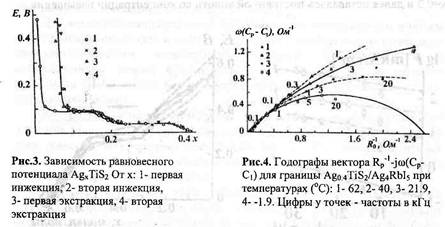
Ситуация меняется, если основное вещество "разбавить" другим похожим соединением, в котором анионов меньше, а катионов — столько же. Тогда катионная решётка этого твёрдого раствора остаётся прежней, а в анионной появляются свободные места — вакансии. Пустые места в отрицательно заряженной решётке можно рассматривать как положительные заряды. Под действием внешнего напряжения в них начнут переходить анионы с достаточно большой энергией, а вакансии "побегут" в противоположном направлении — к катоду. Возникнет электрический ток, обусловленный движением ионов только одного сорта. Это одна из особенностей твёрдых электролитов.
Ионная проводимость тем выше, чем больше в кристалле вакансий. Однако с ростом их количества уменьшается подвижность анионов, причём довольно быстро, поэтому проводимость сначала достигает максимума, а потом начинает падать. Для твёрдых оксидных электролитов на основе ZrO2, например, максимум электропроводности соответствует концентрации катионов 10–15%.
Свойства твёрдых оксидных электролитов
Анионы с достаточной кинетической энергией есть всегда, но при комнатной температуре их очень мало, и твёрдые оксидные электролиты ведут себя как хороший изолятор. По мере нагрева подвижность анионов увеличивается очень быстро, и при 150°С проводимость электролитов становится уже вполне ощутимой. Но основная их рабочая температура лежит между 700 и 1000°С, в связи, с чем они и называются высокотемпературными электролитами.
 А
А
 Б
Б
 В
В
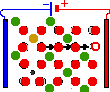 Г
Г
Цветом обозначены:
Зелёный — анион M, Красный — ион G, Жёлтый — анион M *, Фиолетовый — ион M*, Красный с белой точкой — вакансия
Двумерная решётка соединения типа MG2 (например, ZrО2) (А). Ионы элементов G и M образуют регулярные структуры — кристаллические подрешётки. Если смешать два соединения MG2 и M*G (скажем, СаО), в анионной подрешётке G появятся пустые места — вакансии (Б). Соседние катионы при достаточной энергии станут занимать пустые места, и вакансии начнут хаотично двигаться (направление указано стрелками) по кристаллу (В). Если к кристаллу приложить постоянное напряжение, вакансии устремятся к положительному электроду — аноду (Г). Через кристалл — твёрдый электролит — пойдёт электрический ток, обусловленный движением зарядов только одного знака.
Твёрдые электролиты всегда находятся в атмосфере определённых газов, состав которой меняет их свойства. Чтобы понять, в чём тут дело, вспомним, что такое динамическое равновесие. В жидкости, например, всегда есть "быстрые" молекулы, которые с её поверхности переходят в пар. Но и из пара молекулы возвращаются в жидкость — между ними происходит непрерывный обмен молекулами. Пар находится в равновесии с жидкостью, и, чтобы подчеркнуть, что оно сопряжено с движением на молекулярном уровне, его называют динамическим.
Характер обмена между твёрдым телом и газом сложнее. Ион кислорода в поверхностном слое превращается в нейтральный атом. Два атома соединяются в молекулу кислорода, которая отрывается от поверхности и переходит в газ. Возвращение кислорода из газа в твёрдое тело происходит в обратном порядке. Обе эти реакции идут одновременно: между электролитом и газом, содержащим определённое количество кислорода, существует динамическое равновесие. Оно нарушается, когда концентрация кислорода в газе меняется. Итак, твёрдый электролит в виде смеси оксидов циркония и кальция проводит ток только при высоких температурах. Поэтому лампы Нернста включали, предварительно сильно прогрев их стержень. И появление в 1905 году лампы "немедленного действия" с вольфрамовой нитью предопределило её абсолютный успех. Однако известно, что кое-где и сегодня можно встретить странный электрический фонарь, который нужно поджигать спичкой. Это, судя по всему, лампы Нернста, дожившие до наших дней: твёрдые растворы на основе диоксида циркония — исключительно стойкие вещества, они могут работать на воздухе десятилетиями, не окисляясь. Кстати, вполне современные печи с такими нагревателями были разработаны в свердловском Восточном институте огнеупоров в начале 80-х годов.
Главное предназначение твёрдых оксидных электролитов виделось в создании топливных элементов — химических источников тока, в которых энергия газа непосредственно превращается в электрическую. Топливные элементы — близкие родственники гальванических элементов. Но те служат, пока в их электролите и электродах есть активные вещества, а топливные элементы могут работать сколь угодно долго, пока к ним подводится горючее. Систематические исследования твёрдых оксидных электролитов начались в Германии в начале 50-х годов, а с конца 50-х развернулись в СССР, США и Канаде. В нашей стране эти работы с самого начала вёл Институт химии Уральского филиала АН СССР (Свердловск, ныне Екатеринбург), и школа высокотемпературной электрохимии твёрдых электролитов, созданная на Урале, стала уникальной по широте охвата проблемы и глубине её изучения.
Устройства с твёрдыми оксидными электролитами

Цветом обозначены:
Пробирка из ТОЭ, Корпус, Электроды, Нагреватель, Теплоизоляция, Стрелки — потоки газа
Схема электрохимического устройства. Пробирка из твёрдого оксидного электролита с металлическими электродами на стенке помещена в замкнутый объём, окружённый теплоизоляцией. Рабочую температуру около 1000°С создает нагреватель. Внутрь пробирки и в окружающий её объём подаётся газ. Это несложное устройство может работать и как источник тока, и как химический реактор.
Конструкций, в основе которых лежат твёрдые оксидные электролиты, запатентовано очень много, но принцип их действия одинаков и довольно прост. Это пробирка с парой электродов на стенке, снаружи и внутри. Она помещена в нагреватель; внутрь пробирки и в пространство, её окружающее, можно подводить газ. Посмотрим, какие функции могут выполнять такие устройства.
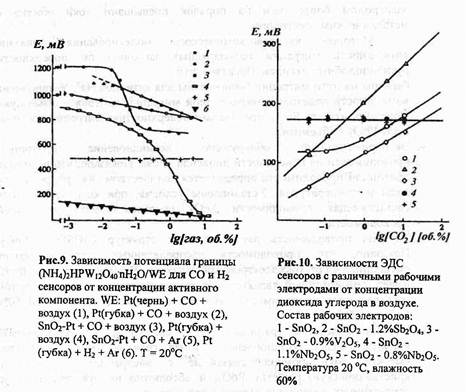
Потенциометрические датчики состава газа. Наверное, они наиболее просты. Мы уже знаем, что электроды в разных газах приобретают разные потенциалы. Если, скажем, внутри пробирки находится чистый кислород, а снаружи — газ с неизвестной его концентрацией, то по разности потенциалов электродов можно эту концентрацию определить.
Потенциометрические датчики позволяют определять состав и более сложных газовых смесей, содержащих углекислый и угарный газы, водород и водяной пар. Если стерженёк из твёрдого электролита с электродами на торцах нагрет неравномерно, он начнёт терять кислород и между электродами возникнет разность потенциалов. По её величине можно определить, например, состав выхлопных газов автомобильного двигателя. На Западе, где требования к чистоте выхлопных газов очень строги, такие датчики выпускаются миллионами. У нас же на такие "пустяки" пока не обращают внимания.
Кислородные датчики пока единственные устройства с твёрдыми оксидными электролитами, нашедшие практическое применение.
Кислородные насосы. Пусть во внешнее пространство пробирки подаётся воздух или газ, содержащий кислород. Если внешний электрод стал анодом, а внутренний — катодом, то из газа в пробирку пойдёт чистый кислород. Подобные устройства — кислородные насосы — могут найти применение там, где потребление кислорода невелико или требуется его высокая чистота.
В медицине, например, используется и чистый кислород, и воздух с пониженным содержанием кислорода — так называемая "гипоксическая смесь", или "горный воздух". Электрохимические насосы наряду с мембранными оксигенаторами (см. "Наука и жизнь" № 2, 1999 г.) позволят решить массу проблем, особенно в медицинских учреждениях, удалённых от промышленных центров. В атмосфере с пониженным содержанием кислорода значительно дольше хранятся продукты питания, и устройства с кислородными насосами могут стать экономичней привычных холодильников.

На основе твёрдых оксидных электролитов можно создавать разные электрохимические устройства. А. Топливный элемент. Внутрь пробирки подаётся водород H2 или угарный газ CO, во внешнее пространство — воздух. На внутреннем электроде газы окисляются, образуя либо воду, либо углекислый газ. Между электродами возникает разность потенциалов. Б. Электролизер для разложения водяного пара и углекислого газа. На внутреннем электроде под действием приложенного напряжения они восстанавливаются до водорода и окиси углерода:
Н2О + 2е– = Н2 + О2–
СО2 + 2е– = СО + О2–
Освободившиеся ионы кислорода O2– мигрируют сквозь стенку трубки, воссоединяются и выделяются на внешнем электроде в виде кислорода O2. В. Кислородный насос. Кислород воздуха, поступающего в пробирку, на внутреннем электроде превращается в O2–, а на внешнем — выделяется в виде чистого кислорода. Г. Датчик состава газа. Воздух или чистый кислород поступает внутрь пробирки, исследуемый газ — во внешнее пространство. На электродах возникнет разность потенциалов, величина которой определяется составом газа.
Электролизеры. Теперь к внешнему электроду — катоду — подводят водяной пар или углекислый газ. На катоде будет происходить разложение пара или углекислого газа, а на аноде в обоих случаях выделяется кислород. Уникальная способность этого высокотемпературного электролизера одновременно разлагать водяной пар и углекислый газ позволяет создать систему жизнеобеспечения, скажем, на космических объектах.
Теплоэлектрогенераторы. Человек сделал первый шаг к независимости от природы, научившись сохранять огонь, поистине универсальный источник энергии. Костёр давал тепло и свет, на нём готовили пищу, он расходовал ровно столько топлива, сколько было необходимо. Костёр тысячелетиями оставался главной энергетической установкой человека, и неудивительно, что мы испытываем какую-то ностальгию по очагу с горящими дровами.
Ещё в конце прошлого века свет давали свечи и керосиновые лампы, а тепло — печи. Лишь немногим более ста лет назад на человека начало работать электричество, которое могло давать свет, тепло, механическую работу. Одно время казалось, что достаточно подвести к жилищу только электрическую энергию, а уж там преобразовывать её во что угодно. Но сказала своё слово экономика: кпд электростанции менее 40%, потери при передаче и обратном превращении электричества в другие виды энергии тоже значительны. Ясно, что там, где нужно только тепло, его целесообразно получать прямо из топлива. И не случайно сегодня обсуждается простая идея: вернуть "очаг" в дом в виде электрохимического генератора с топливным элементом, преобразующим энергию топлива в электричество и тепло.
Топливные элементы. Пусть к внешним стенкам пробирки подаётся водород, а внутрь её — кислород. Между электродами возникнет напряжение около вольта, по соединяющей их цепи потечёт ток, и на электродах пойдут реакции, обратные тем, что проходят в электролизере. Внешний электрод станет анодом, внутренний — катодом, а устройство превратится в источник тока — твёрдооксидный топливный элемент.
Одно и то же устройство может служить и топливным элементом, и электролизером, позволяя аккумулировать электрическую энергию. В период низкого её потребления невостребованная мощность электростанций используется для получения водорода. В пике потребления электролизер начинает работать как топливный элемент, производя электричество из водорода.
Топливом в элементе может быть и угарный газ. В него нетрудно превратить уголь, нефть, различные газы и спирты (которые, например, в Бразилии используют как горючее для автомобилей). Элемент послужит основой электрохимического генератора, способного существенно изменить концепцию снабжения жилища энергией. Наиболее прост в техническом отношении генератор на природном газе — метане или пропане.
Как показывают исследования, его электрический кпд достигает 70%. Остальные 30% энергии топлива выделяются в виде тепла, которое можно использовать в паровых турбинах. Кпд такой комбинированной установки способно превысить 80% — столь высокой эффективности нет ни у одного генератора.
Восемь лет назад в Институте высокотемпературной электрохимии Уральского отделения РАН был изготовлен демонстрационный генератор на метане мощностью один киловатт. Но до практической реализации дело никак не дойдёт. Опытно-конструкторские работы, которые уже начинались, до конца так и не доведены. Задача очень сложна, её необходимо решать в рамках национальной программы, попытки, разработать которую оказались пока безуспешными.
5. Материалы ионики твердого тела
5.1 Исторические сведенья
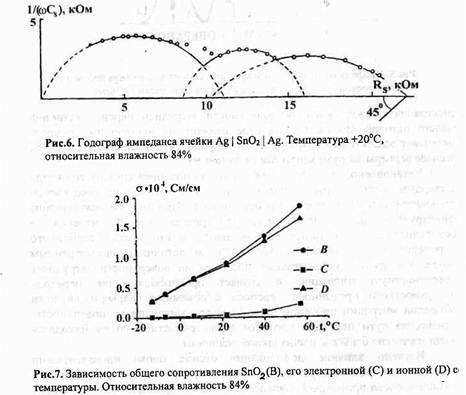
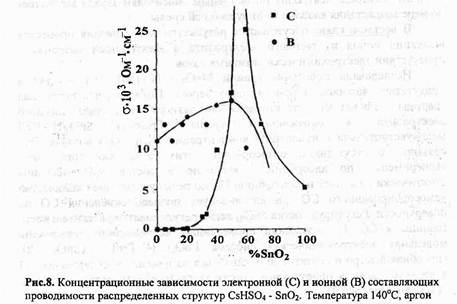
Первые упоминания о высокой проводимости ионных кристаллов относятся, по-видимому, к началу XIX в.: в 1833 г. М.Фарадей отметил аномально большую электропроводность сульфида серебра, сравнимую с таковой для металлов. Аналогичный эффект в оксидных материалах был обнаружен В.Нернстом, который использовал керамику на основе оксида циркония, легированного иттрием, в качестве материала для ламп накаливания. Только в начале XX в. ученые доказали, что высокая проводимость таких веществ обусловлена движением не электронов, а разнозаряженных ионов, как это наблюдается в жидких электролитах. Подобные соединения получили название твердых электролитов или суперионных проводников.
Похожие работы
... не менее пяти циклов разряд – заряд глубиной 250 Кл/см2. Основные результаты и выводы Настоящая работа обобщает результаты комплексного исследования механизма и кинетики электродных процессов в ионной и электронной подсистемах в низкотемпературных твердых электролитах с использованием импульсных методов. Важнейшим результатом работы является получение новых и уточнение полученных другими исс
... важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения веществ - экстракции и ионного обмена. Исследование свойств электролитов стимулируется энергетическими проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты ...
... постановка задачи, сформулированы ее цели, описывается научная и практическая значимость работы. В первой главе приводится анализ литературных данных по проблеме ионной и электронной эмиссии из твердых катионпроводящих электролитов и инжекции ионов в электродные материалы. Рассматриваются проблемы ионного транспорта в твердых электролитах и смешанных ионно-электронных проводниках. Во второй ...
... от теоретических · объяснить отклонения полученных результатов от теоретических · сделать вывод о применимости данного метода определения германия в соединениях для вычисления его массовой доли в твердом электролите GeSe-GeJ2 и об отклонении состава твердого электролита от теоретического. Литературный обзор При подготовке к проведению экспериментальной части курсовой работы был проведен ...
0 комментариев