Навигация
Федеральное агентство по образованию
Пензенский государственный педагогический университет им. В.Г. Белинского
КУРСОВАЯ РАБОТА
Химическая термодинамика
Выполнила студентка группы Х-41(2):
Кямякова Галия Ибрагимовна
Пенза 2008 г.
Содержание
Введение
Глава 1. Первый закон термодинамики
1.1 Вопросы и задания
1.2 Примеры
1.3 Задачи
Глава 2. Приложение первого закона термодинамики к химии. Термохимия
2.1 Вопросы и задания
2.2 Примеры
2.3 Задачи
Глава 3. Второй закон термодинамики. Энтропия
3.1 Вопросы и задания
3.2 Примеры
3.3 Задачи
Глава 4. Термодинамические потенциалы
4.1 Примеры
4.2 Задачи
Литература
Введение
Физическая химия – наука, которая изучает общие закономерности физических процессов и является теоретической основой всей химической науки и технологии химических производств. Наиболее важным и в то же время одним из самых сложных разделов физической химии является химическая термодинамика. В данной курсовой работе приведен перечень вопросов и задач по химической термодинамике. Эти задачи носят комплексный характер и позволяют ученикам подготовиться к химическим олимпиадам. Целью настоящей работы явился подбор заданий по химической термодинамике, адаптация их к требованиям химических олимпиад для школьников, а так же разработка методики их решения с учетом межпредметных связей с математикой и физикой.
Решение задач дает возможность применить теоретические знания на практике, расширить, углубить и систематизировать их, стимулируют мыслительную деятельность учеников, развивают последовательность в действиях, логику.
Глава 1. Первый закон термодинамики
1.1 Вопросы и упражнения
1) Что такое термодинамика и какие явления она изучает?
2) Приведите несколько формулировок первого закона термодинамики и покажите, что они не противоречат друг другу. Почему первый закон термодинамики называют первым началом?
3) Что такое система? Какие ее виды различают?
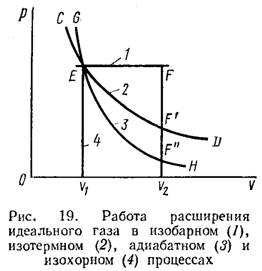
4) Дайте определение и приведите примеры термодинамических процессов: изотермического, изобарического, изохорического и адиабатического.
5) Что такое внутренняя энергия системы и из чего она слагается?
6) Дайте определение идеального газа. Что собой представляет внутренняя энергия идеального газа?
7) Почему термодинамика рассматривает не абсолютное значение внутренней энергии, а только ее изменение?
8) Что такое энтальпия и какова ее связь с внутренней энергией? Почему для конденсированных систем разница между энтальпией и внутренней энергией мала, а для систем газообразных значительна?
9) Перечислите способы передачи энергии от одной системы к другой.
10) Что такое теплота и работа?
11) Дайте определение теплоемкости удельной, атомной, молярной (мольной)? Какая связь существует между мольными теплоемкостями при постоянном давлении и постоянном объеме?
12) Работа определяется двумя величинами: фактором интенсивности и фактором емкости (экстенсивности). Что будут представлять собой эти факторы при совершении механической работы, электрической и работы по расширению газов?
13) Что такое максимальная работа расширения идеального газа? Почему газ, расширяясь в вакууме, работы не совершает?
14) Напишите уравнения, выражающие максимальную работу расширения идеального газа при изотермическом, изобарическом, изохорическом и адиабатическом процессах.
15) Дайте определение обратимым и необратимым термодинамическим процессам. Приведите примеры. Можно ли реальные природные процессы считать полностью обратимыми?
1.2 Примеры
Пример 1-1
Газ расширяясь от 10 до 16 л при постоянном давлении 101,3*103 н/м2, поглощает 126 Дж теплоты. Определите изменение внутренней энергии газа.
Решение:
p1 = p2 = 101,3*103 Па, V1 = 10 л = 1*10-2 м3 ,
V2 =16 л = 16*10-3 м3,
Qp = 126 Дж.
Согласно первому закону термодинамики
DU = Qp – W.
Работа, совершенная газом при изобарическом расширении, может быть вычислена по уравнению
W= p (V2–V1);
Отсюда
DU = Qp - p (V2–V1);
DU = 126 - 101,3*103 (1* 10-2 – 16*10-3) = 481,8Дж
Ответ: 481,8Дж
Пример 1-2Рассчитайте работу изотермического (27°С) расширения 1 моль углекислого газа от 2,24 до 22,4 л.
Решение:
n = 1 моль, V1 = 2,24л = 2,24*10-3 м3 , V2 = 22,4*10-3 м3 ,
Т = 27°С = 300 K.
Работа изотермического расширения системы может быть вычислена по уравнению:
W = nRT *2,3 lg(V2 /V1);
W = 1*8,314*300*2,3 lg (22,4*10-3 / 2,24*10-3) = 5736,66 Дж
Ответ: 5736,66 Дж
Пример 1-3При 273 К и 1,0133*105 Па нагревают 5*10-3 м3 криптона до873 К при постоянном объеме. Определите конечное давление газа и теплоту, затраченную на нагревание.
Решение:
V = 5*10-3 м3, T1 = 273 К, Т2 = 873 К, р1 = 1,0133*105 Па.
Теплоту, затраченную на нагревание можно найти по формуле:
Qv = nCv(T2 – T1).
Количество криптона вычисляется из уравнения состояния идеального газа:
pV = nRT; n = p1V/RT1;
n = 1,0133*105 * 5*10-3 /8,314*273 = 0,223 моль.
Для одноатомных газов Сv = 3/2R ;
Qv = 0,223*3/2*8,314(873 – 273) = 1668,620 Дж
Конечное давление при постоянном объеме и известной температуре можно найти по закону Шарля:
p1/T1 = p2/T2;
p2 = p1T2/ T1;
p2 = 1,0133*105*873/273 = 3,2403*105 Па
Ответ: Qv= 1668,620 Дж, p2= 3,2403*105 Па
Пример 1-4
Один моль одноатомного газа, взятого при 25°С и давлении 1,013*105 Па, адиабатически расширился до 0,05 м3. Каковы будут конечные давление и температура?
Решение:
T1 = 25°С = 298 K, P1 = 1,013*105 Па, V2 = 0,05 м3.
Исходный объем газа (n = 1):
V1 = nRT1/р1 = 1*8,314*298/1,013*105 = 2,445*10-2 м3.
Конечные давление и температуру можно найти из уравнения адиабаты (g = Ср/Сv для одноатомных газов близко к 5/3):
р1V15/3 = р2V25/3,
р2 = р1(V1/ V2 )5/3, р2 = 1,013*105*(2,445*10-2/5,000*10-2)5/3 Па = 0,3*105 Па
Т1V1g-1 = Т2V2g-1, Т2 =Т1 (V1/ V2)g-1,
Т2 = 298*(2,445*10-2/5,000*10-2)5/3 – 1К = 183 К
Ответ: р2 =0,3*105 Па, Т2 = 183 К.
Похожие работы
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... газов в результате реакции. Величина Δn может иметь положительное и отрицательное значения, в зависимости от того, увеличивается или уменьшается число молей газов во время процесса. Применение первого начала термодинамики к процессам в любых системах. Закон Гесса Примем, что единственным видом работы, которая совершается системой, является работа расширения. Подставляя уравнение (II, 5) в ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... в ходе реакции мало, т.е. , тогда ; . При термомеханическом описании реакции опускают , , говорят только об изменении энтальпии : Закон Гесса: тепловой эффект химической реакции протекающий или при или при не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы. Тепловой ...
0 комментариев