Навигация
3.1 Вопросы и упражнения
1) Приведите несколько формулировок второго закона термодинамики и напишите его математическое выражение.
2) Что такое к.п.д.? Почему его значение всегда меньше единицы?
3) В чем состоит значение второго закона термодинамики для физической химии и химической технологии?
4) В отличие от первого закона термодинамики второй закон носит статистический (вероятностный) характер. Что это означает?
5) Что такое свободная и связанная энергия?
6) Что такое энтропия?
7) Как будет изменятся энтропия воды при ее переходе из твердого состояния в жидкое и из жидкого в газообразное?
8) Почему энтропия системы всегда больше нуля?
9) Напишите уравнение изменения энтропии для изотермических обратимых неизолированных, обратимых изолированных и изолированных необратимых процессов.
10) В чем состоит физический смысл изобарно-изотермического и изохорно-изотермического потенциалов? Напишите уравнения, показывающие связь между термодинамическими потенциалами и другими термодинамическими функциями.
11) Что показывает знак и величина изобарно-изотермического потенциала? Определите, какие из нижеприведенных реакций будут протекать в прямом, а какие – в обратном направлении. Какая из этих реакций будет ближе всего к равновесию в момент смешения эквимолярных количеств всех веществ, участвующих в реакции, а какая – дальше всего? Все вещества газообразные, температура и давление постоянны.
| Реакция | Изобарно-изотермический потенциал (дж/моль) |
| a) SO2 + ½ O2 = SO3 b) 2HCl = H2 + Cl2 c) CO + H2O = CO2 + H2 d) 2H2 + O2 = 2H2O | - 69 920 +190 500 - 28 889 - 457 617 |
3.2 Примеры
Пример 3-1
Рассчитайте изменение энтропии при нагревании 0,4 моль хлорида натрия от 20 до 850°С. Мольная теплоемкость хлорида натрия равна:
Ср(NaCl(тв)) = 45,94 +16,32*10-3Т Дж*К-1*моль-1,
Ср(NaCl(ж)) = 66,53 Дж*К-1*моль-1. Температура плавления хлорида натрия 800°С, теплота плавления 31,0 кДж*моль-1.
Решение:
Общее изменение энтропии складывается из трех составляющих:
1) нагревание твердого хлорида натрия от 20 до 800°С,
2) плавление,
3) нагревание жидкого хлорида натрия от 800 до 850°С.
DS1 =![]()
DS2 = ![]()
DS3 = 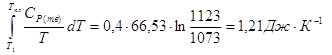
DS = DS1 + DS2 + DS3, DS = (28,94 + 11,6 + 1,21) Дж*К-1 = 41,75 Дж*К-1
Ответ: 41,75 Дж*К-1
Пример 3-2
Найдите изменение энтропии газа и окружающей среды, если n молей идеального газа расширяются от объема V1 до объема V2:
А) обратимо,
Б) против внешнего давления р.
Решение:
А) изменение энтропии газа при обратимом изотермическом расширении можно найти с помощью термодинамического определения энтропии с расчетом теплоты расширения по первому закону:
DSr = Qобр/T = nRlnV2/V1.
Т.к. расширение обратимое, то общее изменение энтропии Вселенной равно 0, поэтому изменение энтропии окружающей среды равно изменению энтропии газа с обратным знаком:
DSокр= -DSr = -n RlnV2/V1.
Б) Изменение энтропии газа при необратимом расширении против внешнего давления будет таким же, как и при обратимом расширении. Другое дело – энтропия окружающей среды, которую можно найти, рассчитав с помощью первого закона теплоту, переданную системе:
DSокр = Qокр/T = - W/Т = р(V1 – V2)/Т.
В этом выводе использован тот факт, что DU = 0 (т.к.температура постоянна). Работа, совершаемая системой против постоянного давления, равна:
W = р(V2 – V1),
а теплота, принятая окружающей средой, равна работе, совершенной системой, с обратным знаком. Общее изменение энтропии газа и окружающей среды больше 0:
DS= n RlnV2/V2 + р(V1 – V2)/Т > 0
как и полагается для необратимого процесса.
Пример 3-3
Рассчитайте изменение энтропии 1000 г метанола в результате его замерзания при -105°С. Теплота плавления твердого метанола при -98°С равна 3160 Дж*моль-1. Теплоемкость твердого и жидкого метанола равны 55,6 и 81,6 Дж*К-1*моль-1, соответственно.
Решение:
Необратимый процесс кристаллизации метанола при температуре -105°С можно представить в виде последовательных обратимых процессов:
А) нагревание метанола от –105°С до температуры кристаллизации (-98°С),
Б) кристаллизация метанола при -98°С,
В) охлаждение метанола от -98°С до -105°С:
![]()
Похожие работы
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... газов в результате реакции. Величина Δn может иметь положительное и отрицательное значения, в зависимости от того, увеличивается или уменьшается число молей газов во время процесса. Применение первого начала термодинамики к процессам в любых системах. Закон Гесса Примем, что единственным видом работы, которая совершается системой, является работа расширения. Подставляя уравнение (II, 5) в ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... в ходе реакции мало, т.е. , тогда ; . При термомеханическом описании реакции опускают , , говорят только об изменении энтальпии : Закон Гесса: тепловой эффект химической реакции протекающий или при или при не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы. Тепловой ...
0 комментариев