Навигация
Термохимические уравнения
3.3. Термохимические уравнения.
Для облегчения расчетов следует поступать так если p=Const, то![]()
![]()
![]()
![]()
Уравнения химических реакций вместе с тепловыми эффектами называются термохимическими уравнениями и с ними можно оперировать как с алгебраическими уравнениями. Запомним, что если:
![]() Qp выделяется,
Qp выделяется,
![]() Qp поглощается
Qp поглощается
3.4. Связь между Qp и QV
![]() .
.
![]()
![]() ,
,
![]()
![]()
![]() ,
,
![]()
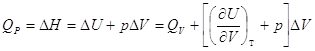
![]() , если реагенты только жидкие или твердые вещества
, если реагенты только жидкие или твердые вещества![]() .
.
![]() , где Δn – изменение числа молей газообразных участников реакции:
, где Δn – изменение числа молей газообразных участников реакции:
CO + H2O = CO2 + H2 Δn = 0 Qp = Qv
N2 + 3H2 = 2NH3 Δn = -2 Qp < Qv
Zn (тв) + H2SO4 (ж) = ZnSO4 (p-p) + H2 (газ) Δn = +1 Qp > Qv
Но для реакции в конденсированной системе:
CuSO4 + 5H2O (ж) = CuSO4 5H2O (кр)
![]()
![]() ,т.е. разница между QP и QV очень мала, ею можно пренебречь.
,т.е. разница между QP и QV очень мала, ею можно пренебречь.
3.5. Теплота образования химических соединений.
Теплотой образования химического соединения называется тепловой эффект реакции образования одного моля данного соединения из соответствующих чисел молей простых веществ.
Стандартной теплотой образования ![]() называется теплота образования химического соединения из простых веществ, находящихся в стандартных условиях, причем продукты реакции также находятся в стандартных условиях. За стандартные условия приняты: температура 25 0С (298,15 К) и 1 атм (760 торр).
называется теплота образования химического соединения из простых веществ, находящихся в стандартных условиях, причем продукты реакции также находятся в стандартных условиях. За стандартные условия приняты: температура 25 0С (298,15 К) и 1 атм (760 торр).
Замечания:
1. Стандартная теплота образования простого вещества равно нулю
2. Простое вещество имеет то агрегатное состояние, в котором оно находится в стандартных условиях.
С (графит) ![]()
С (алмаз) ![]() = 453,2 кал/г-ат
= 453,2 кал/г-ат
О2 (кислород) ![]() = 0 кал/моль
= 0 кал/моль
О3 (озон) ![]() = 34,0 ккал/моль
= 34,0 ккал/моль
Исключение: для фосфора – белый фосфор
Теплоты образования химических соединений обычно вычисляются по экспериментальным теплотам соответствующих химических реакций, например, для I2O5 :
![]()
![]() ?
?
1. ![]()
![]()
2. ![]()
![]()
3. ![]()
![]()
4. ![]()
![]()
![]()
5. ![]()
![]()
![]()
6. ![]()
![]()
7. ![]()
![]()
8. ![]()
![]()
9. ![]()
![]()
По закону Гесса: ![]()
Теплоты образования химических соединений приводятся в справочниках физико-химических величин и для вычисления теплового эффекта химических реакций необходимо из суммы теплот образования продуктов реакции вычесть сумму теплот образования исходных веществ: ![]()
Заметим, что в дальнейшем изложении мы введем еще ряд функций состояния и для них закон Гесса также справедлив.
Похожие работы
... тем существенным фактором, который отличает необратимые процессы в изолированных системах от аналогичных процессов в неизолированных, или открытых, системах. Второе начало термодинамики и утверждение о возрастании энтропии при любом необратимом процессе было сформулировано именно для изолированных систем. Значит, нельзя просто переносить его на неизолированные системы. Чтобы перейти к описанию ...
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... . Но публикация этого вывода была осуществлена уже после признания закона сохранения энергии, поэтому данный вывод не сыграл той роли. которую мог сыграть, будучи опубликованным ранее. Но так или иначе Карно заложил основы термодинамики как раздела физики, изучающего наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между ...
0 комментариев