Навигация
Уравнение Клапейрона-Клаузиуса
6.3. Уравнение Клапейрона-Клаузиуса.
Очевидно, что ![]() , где V’,V’’,S’,S” мольные объемы и мольные энтропии компонента в фазах (‘) и (“). Из условий равновесия
, где V’,V’’,S’,S” мольные объемы и мольные энтропии компонента в фазах (‘) и (“). Из условий равновесия ![]() или
или ![]() - изменение энтропии и объема при переходе 1 моля компонента из фазы (‘) в фазу (“), т.е. это мольные изменения энтропии и объема фазового превращения.
- изменение энтропии и объема при переходе 1 моля компонента из фазы (‘) в фазу (“), т.е. это мольные изменения энтропии и объема фазового превращения.
Учитывая, что фазовое превращение рассматривалось как равновесное и изотермическое, то ![]() - теплота фазового превращения и окончательно:
- теплота фазового превращения и окончательно: ![]() уравнение Клапейрона–Клаузиуса.
уравнение Клапейрона–Клаузиуса.
Заметим, что в уравнении Клапейрона ΔH и ΔV относятся к одноименным процессам и на одно и тоже количество вещества.
6.4. Фазовое равновесие в конденсированных системах.
Конденсированной системой называется такая, в которой не имеется в наличии газообразная фаза, а только твердые или жидкие или те и другие вместе.
Наиболее интересным является равновесие кристалл ↔ жидкость. Поскольку теплота плавления всегда положительна, знак производной ![]() будет зависеть от знака ∆V. Для большинства веществ ∆V>0 (Vж > Vкр), и производная положительна, т.е. температура лавления будет расти с ростом давления. Однако у некоторых веществ (H2O, Ga, Bi, Sb, Ge, Si и др.) при плавлении происходит уменьшение объема, Vж < Vкр, и температура плавления понижается с повышением давления. Так для воды
будет зависеть от знака ∆V. Для большинства веществ ∆V>0 (Vж > Vкр), и производная положительна, т.е. температура лавления будет расти с ростом давления. Однако у некоторых веществ (H2O, Ga, Bi, Sb, Ge, Si и др.) при плавлении происходит уменьшение объема, Vж < Vкр, и температура плавления понижается с повышением давления. Так для воды ![]()
Если предположить, что для конденсированных систем ∆H и ∆V не зависят ни от давления, ни от температуры, то уравнение Клапейрона-Клаузиуса легко интегрируется ![]() .
.
Интересным является рассмотрение равновесия С (графит) →С (алмаз). Использование справочных данных для энтальпий образования и энтропий графита и алмаза дает для этого превращения ![]() , откуда видно, что при любых температурах
, откуда видно, что при любых температурах ![]() . Но поскольку
. Но поскольку ![]() , то с увеличением давления ∆rG должна уменьшаться и при данной температуре графит и алмаз находятся в равновесии, тогда когда ∆rG = 0. Предположив, что ∆V не зависит от давления, получим после интегрирования.
, то с увеличением давления ∆rG должна уменьшаться и при данной температуре графит и алмаз находятся в равновесии, тогда когда ∆rG = 0. Предположив, что ∆V не зависит от давления, получим после интегрирования.
![]() откуда
откуда ![]() .
.
Подставив численные значения ∆rG0 и ∆V получим Р (атм) = 9448 + 17,42 Т
При 300 К Р=14670 атм.
1000 К Р=26870 атм.
1500 К Р=35580 атм., т.е. равновесные давления имеют порядок десятков тысяч атм.
Далее 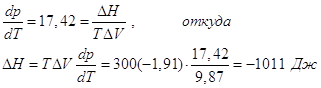 , и мы видим, что при высоком давлении поменялся даже знак теплового эффекта. Действительно, возьмем уравнение Гиббса-Гельмгольца:
, и мы видим, что при высоком давлении поменялся даже знак теплового эффекта. Действительно, возьмем уравнение Гиббса-Гельмгольца:
![]() и возьмем производную по давлению:
и возьмем производную по давлению:
![]() .
.
После интегрирования и ряда упрощений имеем:
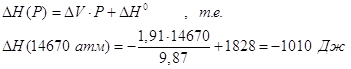 .
.
6.5. Интегрирование уравнения Клапейрона-Клаузиуса для процесса парообразования.
Переход жидкости в пар называют испарением, обратный процесс конденсацией. Испарение твердых тел называют возгонкой или сублимацией, обратный – кристаллизацией. Пар, который находится в равновесии с конденсированной фазой, называется насыщенным паром.
Поскольку теплота парообразования положительна, а мольный объем пара больше мольного объема конденсированной фазы, это значит, что производная в уравнении Клапейрона-Клаузиуса ![]() т.е. с ростом температуры давление насыщенного пара увеличивается.
т.е. с ростом температуры давление насыщенного пара увеличивается.
При температурах, далеких от критических, мольный объем пара много больше мольного объема конденсированной фазы, поэтому последним можно пренебречь, а если в этой области температур насыщенный пар подчиняется уравнению состояния идеального газа, то: ![]() , и уравнение Клапейрона-Клаузиуса можно представить в виде:
, и уравнение Клапейрона-Клаузиуса можно представить в виде: ![]() .
.
В нешироком интервале температур теплоту испарения можно считать постоянной и взятие определенного интеграла дает: 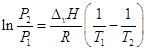 .
.
Таким образом, если известна ∆v H, то, зная давление насыщенного пара вещества при одной температуре, можно рассчитать давление насыщенного пара при другой температуре. С другой стороны, определив давление насыщенного пара при двух (по крайней мере) температурах, можно рассчитать теплоту испарения.
Взятие неопределенного интеграла дает (при ∆v H = const) ![]() или
или ![]() , где А и В – константы, характерные для данного вещества. Это уравнение, линейное в координатах ln p – 1/T, дает прямую линию в значительном интервале температур. Более точным является уравнение Антуана:
, где А и В – константы, характерные для данного вещества. Это уравнение, линейное в координатах ln p – 1/T, дает прямую линию в значительном интервале температур. Более точным является уравнение Антуана: ![]() , где А, В, С – константы.
, где А, В, С – константы.
Практически полезным может оказаться правило Трутона: энтропия испарения вещества в нормальной точке кипения (при 1 атм.) равна приблизительно 90 Дж/моль*К. Тогда в уравнение Клапейрона-Клаузиуса входит только одна константа Тнтк – температура нормальной точки кипения:
![]() .
.
По этому уравнению удобно рассчитывать температуру перегонки органических соединений под пониженным давлением. Однако следует отметить, что правило Трутона соблюдается только для «нормальных» жидкостей, т.е. таких молекулы которых не ассоциированы в жидкой фазе (как у воды за счет водородных связей), а также, если пары не состоят из полимерных или диссоциированных молекул.
Для уксусной кислоты прямые определения теплоты испарения в калориметре при температуре кипения СН3СООН равной 391К дает величину 406 Дж/г. С другой стороны при 363 К давление пара 293 торр, при 391К и 760 торр. Заменив производную в уравнении Клапейрона-Клаузиуса отношением конечных приращений имеем:
 .
.
Мольная масса СН3СООН равна 60, тогда из калориметрических данных:
![]()
![]() .
.
Расхождение между этими двумя значениями связано с тем, что для получения одного моля пара необходимо испарить больше, чем 60 г СН3СООН, следовательно, мольная масса пара СН3СООН равна:
![]() , отсюда легко сообразить, что пары уксусной кислоты в этом температурном интервале димеризованы примерно на 2/3.
, отсюда легко сообразить, что пары уксусной кислоты в этом температурном интервале димеризованы примерно на 2/3.
Насыщенный пар обладает еще рядом интересных свойств. Рассмотрим некоторые из них.
Пусть в гетерогенной системе при температуре Т находится 1 моль вещества, причем в равновесии находятся m молей пара и 1-m молей жидкой фазы. Пусть теплоемкость пара Сп, жидкости Сж, изменяем температуру от Т до T+dT, при этом испаряется масса жидкости dm, тогда затраты тепла dQ можно представить в виде соотношения:
![]() .
.
Разделим правую и левую части на Т, имеем:
![]() .
.
Следовательно, справедливо: ![]() ,
,
после дифференцирования имеем ![]() .
.
По уравнению Кирхгоффа ![]() и
и  ,
,
т.е. теплоемкость насыщенного пара не равна изобарной теплоемкости того же газообразного вещества.
Следует также иметь в виду, что введение постороннего (инертного) газа изменяет давление насыщенного пара при неизменной температуре, даже если газ не растворяется в жидкости. Это происходит вследствие влияния общего давления на свойства конденсированной фазы (возрастает ее мольная энергия Гиббса). Действительно, при T=const:
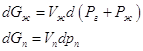 , где Рг – давление постороннего газа, Рж давление насыщенного пара, Vж и Vп - мольные объемы жидкости и пара. Поскольку по условию равновесия dGж =dGп, то:
, где Рг – давление постороннего газа, Рж давление насыщенного пара, Vж и Vп - мольные объемы жидкости и пара. Поскольку по условию равновесия dGж =dGп, то: ![]() .
.
Взятие интеграла от Рг = 0 до Рг приводит к уравнению: ![]()
Поскольку дробь Vж/Vn невелика (для воды при 373 К она равна 5,9∙10-4), то влияние постороннего газа сказывается только при высоких давлениях.
Например, для воды под давлением водорода при 373 К
|
| 25 | 200 | 600 | 1000 | |
|
| Эксп. | 1,018 | 1,19 | 1,66 | 2,35 |
| Расч. | 1,015 | 1,12 | 1,35 | 1,802 |
Глава 7. Термодинамические свойства многокомпонентных систем. Растворы. Химический потенциал.
Похожие работы
... тем существенным фактором, который отличает необратимые процессы в изолированных системах от аналогичных процессов в неизолированных, или открытых, системах. Второе начало термодинамики и утверждение о возрастании энтропии при любом необратимом процессе было сформулировано именно для изолированных систем. Значит, нельзя просто переносить его на неизолированные системы. Чтобы перейти к описанию ...
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... . Но публикация этого вывода была осуществлена уже после признания закона сохранения энергии, поэтому данный вывод не сыграл той роли. которую мог сыграть, будучи опубликованным ранее. Но так или иначе Карно заложил основы термодинамики как раздела физики, изучающего наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между ...
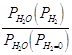
0 комментариев