Навигация
Закон Джоуля
4.5. Закон Джоуля
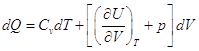 ,
,
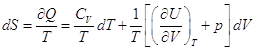 – это полный дифференциал, следовательно
– это полный дифференциал, следовательно 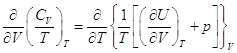 .
.
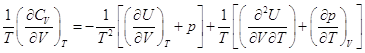 ,
, ![]()
![]()
![]() .
.
Для идеального газа ![]()
![]() и
и ![]() ,
,
Для любых систем ![]() ,
,
Для газа Ван-дер-Ваальса ![]() и
и ![]() .
.
4.6. Постулат Планка. Абсолютная энтропия.
Зададимся вопросом, каково изменение энтропии некоего процесса, который протекает при температуре около абсолютного нуля. Например, имеем две кристаллические модификации металлического олова: низкотемпературную, α - Sn, и высокотемпературную – обычное белое олово, β – Sn. Они находятся в равновесии при 14 0С (287 К), теплота равновесного превращения 497 кал/моль, а энтропия его ![]()
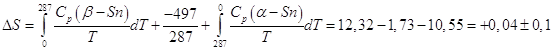 ,
,
т.е. изменение энтропии в пределах ошибок опыта равно нулю, а отсюда следует, что энтропии α – Sn и β – Sn одинаковы.
Исходя из многочисленных подобных экспериментов (мы их обсудим позднее в гл.16), Планк выдвинул постулат: энтропия идеального кристаллического тела при абсолютном нуле равна нулю.
Абсолютные энтропии веществ, измеренные экспериментально или вычисленные теоретически, приводятся в справочниках термодинамических величин (где и теплоты образования).
Глава 6. Равновесие в однокомпонентных гетерогенных системах.
Уравнение Клапейрона – Клаузиуса6.1. Определения.
Фазой называется совокупность частей системы, обладающих одинаковыми термодинамическими свойствами. Система, состоящая из одной фазы, называется гомогенной, из двух или более – гетерогенной. Фаза более общее понятие, чем индивидуальное вещество. Система может состоять из одного вещества, но быть гетерогенной (вещество находится в системе в виде разных агрегатных состояний или кристаллических модификаций). Система может быть гомогенной, но содержать несколько химических соединений, пример этого – растворы.
Назовем составляющими веществами системы такие химические соединения, которые могут быть выделены из системы, и существовать отдельно от нее. Назовем независимыми компонентами такие составляющие вещества, концентрации которых могут изменяться независимо. Если в системе не протекают химические реакции, то все вещества, составляющие систему, являются независимыми компонентами.
Но в случае фактического протекания химических реакций концентрации только части веществ могут изменяться независимо, поэтому число независимых компонентов равно числу составляющих веществ минус число химических реакций, которые фактически протекают в системе.
6.2. Условия равновесия и направление самопроизвольного процесса в однокомпонентной гетерогенной системе.
Пусть гетерогенная однокомпонентная система имеет две фазы (΄) и (˝), а мольные энергии Гиббса компонента в каждой из фаз G΄ и G˝ соответственно. Пусть давление и температура постоянны, а изменение чисел молей компонента в фазе (´) равно![]() , в фазе (´)
, в фазе (´) ![]() , тогда изменение энергии Гиббса системы равно:
, тогда изменение энергии Гиббса системы равно: ![]() .
.
Если система закрытая, то ![]() , и
, и ![]() .
.
При равновесии ![]() , а это возможно, когда
, а это возможно, когда ![]() , т.е. при равновесии мольные энергии Гиббса компонента в фазах равны.
, т.е. при равновесии мольные энергии Гиббса компонента в фазах равны.
Самопроизвольный процесс в системе может протекать только в сторону уменьшения энергии Гиббса системы, т.е. ![]() . Положим, для определенности, что
. Положим, для определенности, что ![]() тогда
тогда ![]() , если же. Это значит, что компонент самопроизвольно переходит из той фазы, где его мольная энергия Гиббса больше, в ту фазу, где его мольная энергия Гиббса меньше.
, если же. Это значит, что компонент самопроизвольно переходит из той фазы, где его мольная энергия Гиббса больше, в ту фазу, где его мольная энергия Гиббса меньше.
Изменим давление и температуру на бесконечно малые величины dT и dp, тогда очевидно, что если система остается равновесной и гетерогенной ![]() следовательно, и
следовательно, и ![]() .
.
Похожие работы
... тем существенным фактором, который отличает необратимые процессы в изолированных системах от аналогичных процессов в неизолированных, или открытых, системах. Второе начало термодинамики и утверждение о возрастании энтропии при любом необратимом процессе было сформулировано именно для изолированных систем. Значит, нельзя просто переносить его на неизолированные системы. Чтобы перейти к описанию ...
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... . Но публикация этого вывода была осуществлена уже после признания закона сохранения энергии, поэтому данный вывод не сыграл той роли. которую мог сыграть, будучи опубликованным ранее. Но так или иначе Карно заложил основы термодинамики как раздела физики, изучающего наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между ...
0 комментариев