Навигация
Зависимость теплового эффекта химической реакции от температуры
3.6. Зависимость теплового эффекта химической реакции от температуры.
Если Hi мольная энтальпия химического соединения, то ![]() . Очевидно, что для некоторой химической реакции
. Очевидно, что для некоторой химической реакции ![]() и
и ![]() .
.
Дифференцирование по температуре, разделение переменных и интегрирование в интервале от Т1 до Т2 дают (р = const):
![]()
![]()
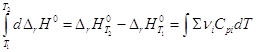
и 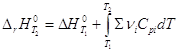 уравнение Кирхгоффа
уравнение Кирхгоффа
Аналогично для ΔU и Cv.
Глава 4. Второй закон.
4.1. Определение.
Каждая термодинамическая система обладает функцией состояния -энтропией. Энтропия процесса вычисляется следующим образом. Система переводится из начального состояния в соответствующее конечное состояние через последовательность состояний равновесия, вычисляются все подводимые при этом к системе порции тепла dQ, делятся каждая на соответствующую ей абсолютную температуру Т источника теплоты и все полученные таким образом значения суммируются: ![]() и
и ![]() .
.
При реальных (неидеальных) процессах энтропия замкнутой (изолированной) системы возрастает ![]() , т.е.
, т.е. ![]() .
.
Энтропия – способность к превращению (Клаузиус)
По I закону ![]() и для идеального газа
и для идеального газа
![]() и
и ![]() .
.
![]() , т.е. для идеального газа
, т.е. для идеального газа ![]() обладает свойствами полного дифференциала, т.е. S есть функция состояния.
обладает свойствами полного дифференциала, т.е. S есть функция состояния.
| Распространение |
4.2. Другие формулировки
Тепло не может само по себе перейти от системы с меньшей температурой к системе с большей температурой (Клаузиус).
Невозможно получать работу, только охлаждая отдельное тело ниже температуры самой холодной части окружающей среды (Кельвин).
4.3. Обратимые и необратимые процессы.
Процесс называется равновесным, если в прямом и обратном направлении проходит через одни и те же состояния бесконечно близкие к равновесию. Работа равновесного процесса имеет максимальную величину по сравнению с неравновесными процессами и называется максимальной работой.
Если равновесный процесс протекает в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние и в результате процесса не остается никаких изменений во всех участвовавших в процессе телах, то процесс называется обратимым.
Обратимый процесс – такая же абстракция, что и идеальный газ.
Крайние случаи необратимых процессов: переход энергии от горячего тела к холодному в форме теплоты при конечной разнице температур, переход механической работы в теплоту при трении, расширение газа в пустоту, диффузия, взрывные процессы, растворение в ненасыщенном растворе.
Эти необратимые процессы идут самопроизвольно без воздействия извне и приближают систему к равновесию.
4.4. Изменение энтропии в различных процессах.
![]() , причем знак = относится к обратимым процессам, а знак > к необратимым.
, причем знак = относится к обратимым процессам, а знак > к необратимым.
Если требуется вычислить энтропию необратимого процесса необходимо провести обратимый процесс между теми же самыми конечным и начальным состоянием (используем тот факт, что энтропия – функция состояния).
а) Изотермический процесс:
![]() , Q – часто это скрытая теплота фазовых переходов.
, Q – часто это скрытая теплота фазовых переходов.
б) Изменение температуры при ![]()
![]() :
:
![]()
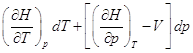 , следовательно
, следовательно 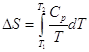 , т.к.
, т.к. ![]()
Энтропия необратимого процесса: ![]()
Теплота конденсации при 298 К равна – 10519 кал, ![]()
Ответ, очевидно, неверен, поскольку процесс необратимый. Проведем его обратимо: ![]()
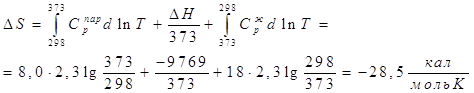
(-9769 – теплота конденсации при 373 К)
![]()
Заметим, что действительно ![]() меньше, чем
меньше, чем ![]() .
.
Похожие работы
... тем существенным фактором, который отличает необратимые процессы в изолированных системах от аналогичных процессов в неизолированных, или открытых, системах. Второе начало термодинамики и утверждение о возрастании энтропии при любом необратимом процессе было сформулировано именно для изолированных систем. Значит, нельзя просто переносить его на неизолированные системы. Чтобы перейти к описанию ...
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... . Но публикация этого вывода была осуществлена уже после признания закона сохранения энергии, поэтому данный вывод не сыграл той роли. которую мог сыграть, будучи опубликованным ранее. Но так или иначе Карно заложил основы термодинамики как раздела физики, изучающего наиболее общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между ...
0 комментариев