Навигация
Монослой клеток фиксируют при помощи обычных фиксаторов и окрашивают генциан-виолетом или метиленовым сидим
4. Монослой клеток фиксируют при помощи обычных фиксаторов и окрашивают генциан-виолетом или метиленовым сидим.
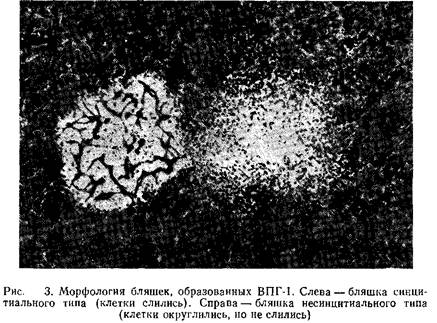
Вирусные бляшки можно обнаружить и невооруженным глазом, однако для их подсчета следует воспользоваться стереомикроскопом. Бляшки вирусов простого герпеса различаются по морфологии. Некоторые штаммы вызывают слияние клеток, что приводит к образованию больших синцитиальных бляшек, в то время как другие штаммы вызывают округление клеток. На рис. 3 для сравнения показана морфология описанных выше бляшек. Однако во многих случаях продолжительная инкубация клеток с вирусом, вызывающим образование синцитиев, приводит к изменению картины ЦПД. Бляшки при этом приобретают несинцитиальный характер.
1.3.2 Титрование на монослойной культуре
При использовании данного метода особенно важен выбор соответствующей клеточной линии. Как правило, инфицирование монослоя клеток ВНК приводит к образованию мелких бляшек. Кроме того, частота их возникновения, как свидетельствует наш опыт, также небольшая. При титровании вируса на монослойных культурах мы обычно используем клетки Vero, на которых эффективность бляшкообразования такая же, а для некоторых штаммов даже выше, чем на ВНК, находящихся в суспензии.
1. Клетки Vero рассевают в количестве 2–106 клеток на чашку за 18–24 ч до заражения.
2. Из чашек отсасывают среду и клетки инфицируют 0,1 мл соответствующего разведения вируса. Для адсорбции вируса чашки инкубируют 1 ч при 37°С.
3. В каждую чашку добавляют по 5 мл 2%-ной КМЦ, приготовленной на культуральной среде, и культуры инкубируют при 37°С. Время инкубации сильно варьирует в зависимости от штамма вируса. Быстрорастущий ВПГ-2 формирует хорошо различимые бляшки всего за 2 дня, в случае других вирусов требуется 4 дня.
4. Клетки фиксируют и окрашивают, как описано выше.
1.3.3 Среды для титрования
Существует множество разнообразных сред, используемых при титровании суспензионных и монослойных культур. Тем не менее мы предпочитаем среду, содержащую КМЦ, поскольку она удобна в работе и не ограничивает рост бляшек. Однако во время культивирования чашки должны находиться на ровной поверхности, и работать с ними следует осторожно, поскольку любое повреждение слоя КМЦ может привести к искажению картины бляшек.
1.3.4 Метод "оспин"
ВПГ-1 и ВПГ-2 формируют "оспины" на хорионаллантоисной мембране куриных эмбрионов. Существует предположение, что с помощью этого метода можно различить ВПГ-1 и ВПГ-2.
1.4 Приготовление экстрактов клеток, инфицированных вирусом
Тотальные гомогенаты клеток, инфицированных вирусом, или детергентные экстракты таких клеток обычно используются в качестве антигенов в различных иммунологических реакциях, таких, как ELISA и RIA. Кроме того, их применяют для иммунизации при получении гипериммунных антисывороток или моноклональных антител к белкам ВПГ. Поэтому выбор инфицируемой клеточной линии зависит от дальнейшего использования антигена.
1. Для радиоиммунологических методов используют клетки Vero или ВНК, которые заражают при множественности инфекции 10 БОЕ/мл.
2. Клетки вместе с культуральной средой собирают через 18–24 ч после заражения и центрифугируют при малой скорости.
3. Клеточный осадок дважды промывают PBS, а затем ресуспендируют в дистиллированной воде таким образом, чтобы концентрация клеток по возможности составляла 1-108 кл/мл.
4. Суспензию инфицированных клеток разрушают в ультразвуковой бане и хранят при –70°С. На рис. 6 показаны полипептиды, присутствующие в такой фракции.
Для некоторых методов, например иммунопреципитации, требуется фракция растворимого антигена. Такую фракцию получают центрифугированием суспензии разрушенных инфицированных клеток. С целью увеличения количества мембранных белков в этой фракции можно использовать детергенты. Свойства полученного антигена необходимо проверить при помощи ELISA или диффузией в геле по методу Оухтерлони, используя кроличью гипериммунную сыворотку к зараженным вирусом герпеса клеткам. Антиген для иммунизации получают, как описано выше, однако выбору клеток уделяют особое внимание. Например, для иммунизации животных с целью получения моноклональных антител используют антиген, выделенный из инфицированных L-клеток мыши, в то время как для получения кроличьих сывороток – антиген, выделенный из инфицированных клеток почки кролика RK13, растущих в присутствии 5% кроличьей сыворотки.
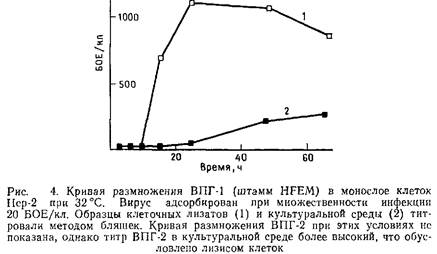
1.5 Получение очищенного вируса
Методы выделения вирусов простого герпеса довольно сложны по сравнению с другими вирусами. Более того, метод, хорошо зарекомендовавший себя при работе с одним штаммом вируса на определенной клеточной линии, может оказаться неприемлемым для других штаммов на той же линии или того же штамма вируса на других клетках. Поэтому мы опишем два метода. Мы показали, что первый метод можно успешно применять для получения штамма HFEM и некоторых других при условии, что для выращивания вируса используют клетки Нер-2. Данный метод прост и позволяет получать вирусные препараты высокой степени чистоты. Второй метод позволяет достигнуть удовлетворительных результатов со всеми штаммами вируса и различными типами клеток. Для выбора оптимальных условий получения высокого выхода вируса и качественного исходного материала для дальнейшей очистки следует вначале изучить кривую роста исследуемого вирусного штамма на различных линиях клеток. На рис. 4 показана кривая роста штамма HFEM на клетках Нер-2 при высокой множественности инфекции и культивировании клеток при 32°С.
1.5.1 Метод 1
1. Культуры Нер-2 в состоянии монослоя заражают при множественности инфекции 20–25 БОЕ/кл.
2. После адсорбции вируса зараженные клетки промывают, добавляют свежую среду и культивируют 2–3 дня при 32°С.
3. При необходимости радиоактивного мечения вирусоспецифических белков в культуральную среду вносят изотопы через 4 ч после начала культивирования.
4. По окончании культивирования культуральную среду центрифугируют при низкой скорости для удаления клеточного дебриса.
5. Вирус осаждают ПЭГ в присутствии 0,5 М NaCl или центрифугированием в роторе GSA в центрифуге Sorvall RCS-5B.
6. Вирус ресуспендируют в трис-буфере низкой молярности, рН 7,8, содержащем 50 мМ NaCl. Полученную суспензию по возможности лучше оставить на ночь.
7. Вирусную суспензию наслаивают на 30 мл 5–45%-ного градиента сахарозы в указанном выше буфере и центрифугируют 1 ч при 12500 об/мин. После центрифугирования в центре градиента четко видна рыхлая белая полоса очищенного вируса. Эта видимая невооруженным глазом полоса и есть единственная в градиенте фракция инфекционного вируса.
Полученный вирус уже достаточно очищен, и его можно использовать в различных целях, в частности для выделения вирусной ДНК. Из фракции вирус легко осадить обычным центрифугированием. Для получения вирусных препаратов высокой степени чистоты может быть использован ряд других методов, включая повторное центрифугирование в градиенте сахарозы или CsCl. Эти методы позволяют получать препараты вируса, в которых отношение белка к числу частиц составляет менее чем 20 мкг на 1010 частиц.
1.5.2 Метод 2
Данный метод был разработан Спир и Ройзманом и Хейном и др.
1. Заражение клеток проводят по методу 1.
2. Клетки инкубируют 18–24 ч при 37°С, затем их снимают с подложки и центрифугируют при малой скорости.
3. Полученный таким образом клеточный осадок ресуспен-дируют в стандартном буфере для ретикулоцитов и в течение 10 мин дают клеткам набухнуть. Цитоплазматическую фракцию клеток получают в гомогенизаторе Даунса.
4. Клеточный гомогенат центрифугируют при малой скорости для удаления ядер и клеточного дебриса.
5. Супернатант, содержащий большую часть инфекционного вируса, наслаивают на 5–40%-ный градиент декстрана, приготовленный на трис-буфере, и центрифугируют 1 ч при 12500 об/мин. Фракция вируса видна невооруженным глазом в центре градиента.
6. Вирус из фракции осаждают центрифугированием в течение 1 ч при 20000 об/мин.
Полученный вирус уже достаточно очищен и может быть использован в различных целях. Кроме того, степень чистоты вируса можно повысить, как описано выше. Очищенный вирус, полученный любым методом, ресуспендируют в дистиллированной воде или в соответствующем буфере. Аликвоты суспензии можно использовать для заражения клеток, подсчета общего числа частиц и определения концентрации белка. Вирус хранят при –70°С, однако следует учитывать, что оттаивание ведет к частичному разрушению вирусной оболочки. На рис. 5 показаны различные вирусные частицы, обнаруженные в препаратах очищенного вируса.
Похожие работы
... , жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах. Микробиологические методы Микробиологические методы — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт наличия возбудителя в исследуемом материале. Идентификацию чистых культур ...
... фагами, либо путем выталкивания участков цитоплазмы, либо, наконец, путем выхода отдельных вирионов или небольших их групп. Некоторые вирусы животных с трудом освобождаются из клеток в культурах in vitro; в живом организме выходу таких вирусов из клеток и их распространению способствует захват поврежденных вирусом клеток фагоцитами и их переваривание. Вирусы растений обычно не освобождаются путем ...
... часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей ...
... через 13, перманганат калия 1 : 1000 через 10 мин. Микроб очень чувствителен к антибиотикам тетрациклинового ряда, в меньшей степени — к пенициллину и синтомицину, устойчив к мицелину и колимицину. Эпизоотология. В естественных условиях болеют овцы независимо от возраста, пола и породности. Из лабораторных животных чувствительны кролики и белые мыши, менее восприимчивы морские свинки, голуби. ...
0 комментариев