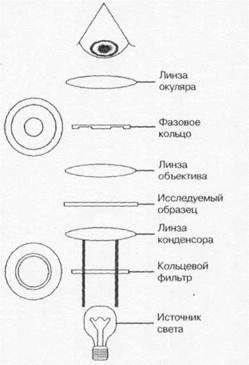
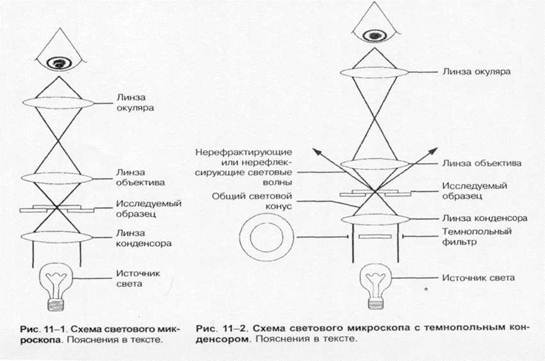
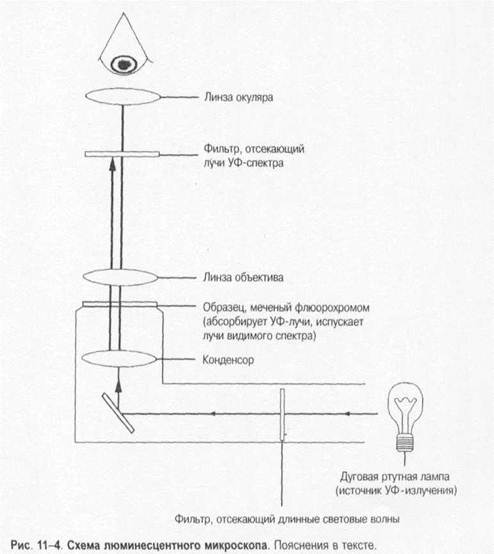
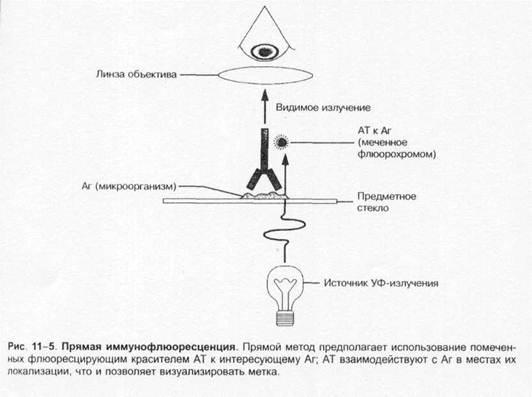
Навигация
Герпесвирус саймири
3. Герпесвирус саймири
Герпесвирус саймири можно выделить из крови и культуры клеток большинства здоровых обезьян саймири. Для своих природных хозяев этот вирус не патогенен. Однако он стал предметом пристального внимания ученых после того, как была продемонстрирована его высокая онкогенность для тканей других приматов, в особенности мармозеток из рода Saguinus. У последних в течение 2 мес после заражения развиваются злокачественные опухоли лимфатической системы. Показано, что герпесвирус саймири относится к f-субгруппе герпесвирусов.
3.1 Получение заготовок вируса
Из большого количества проанализированных клеточных культур для литической инфекции и роста различных штаммов HVS наиболее пригодной оказалась линия клеток почки обезьян дурукули. Кроме того, за небольшим исключением, для получения заготовок HVS можно использовать и клетки линии Vero. Клетки ОМК можно выращивать на большинстве культуральных сред с добавлением ТС.
Для получения заготовок вируса клетки ОМК, растущие в роллерных флаконах, заражают вирусом и культивируют 4–5 дней при 37°С. Оптимальная температура культивирования – 34°С. Однако культивирование при этой температуре может привести к возникновению температурно-чувствительных мутантов. ЦПД проявляется в образовании шарообразных агрегатов клеток, не являющихся истинными синцитиями.
Как правило, ЦПД удается обнаружить на 4–5 день после заражения, хотя эти сроки могут варьировать для различных штаммов. Дочерние вирусы высвобождаются в культуральную среду, при этом в 50 мл среды одного роллерного флакона содержится примерно 2–106–2-107 БОЕ/мл. Вирусную суспензию с таким титром следует хранить при –70°С, кроме того, вирус можно предварительно сконцентрировать осаждением. Осажденный вирус обычно характеризуют отношением числа физических частиц к инфекционным. Для штамма HVS 11 данное отношение составляет 200–500, этот штамм на редкость стабилен при 4°С. Он теряет за месяц при хранении в культуральной среде всего лишь 0,51g инфекционности.
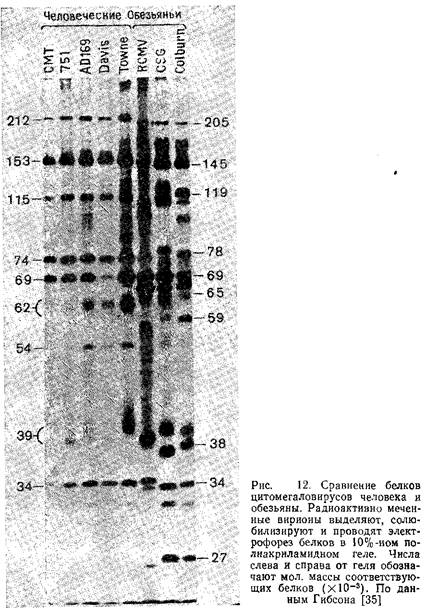
Таблица 3. Характерные особенности белков CMV
| Сходные белки различных штаммов CMV | Природа белков | Характеристики | |||
| Colburn | CSG | RCMV | HCMV 751 | ||
| 205 | 205 | 207 | 212 | Высокомолекулярный белок | Самый большой белок вириона |
| 163 | 263 | - | 145 | Кислый гликопротеин | Кислый гликозилированный белок |
| 145 | 143 | 150 | 153 | Основной белок капсида | Главный, структурный белок капсида |
| 129 | 129 | 129 | 140 | Белок отсутствует | |
| 119 | 114 | 100 | 149 | Щелочной фосфопротеин | Мажорный фосфорили-рованный, щелочной белок |
| 119 | н. о. | н. о. | – | GP119 | Гликозилированный, кислый |
| 112 | 112 | 112 | 115 | Белок вириона | |
| 100 | н. о. | н. о. | – | GP100 | Гликозилированный, кислый |
| 94 | 90 | 92 | 79 | Предранний | Отсутствует в вирионе, кислый, фосфорилирован |
| 78 | 82 | 75 | 80 | Содержится в вирионе | |
| 69 66 | 69 66 | 69 66 | 74 69 | Белок внешнего матрикса Белок внутреннего матрикса | Мажорный белок, фосфорилирован Мажорный, фосфорилирован, локализуется |
| 65 61 | 64 | 65 | 62 54 57 | Гликопротеин | Мажорный, гликозилированный |
| н. о. | н. о. | Гликопротеин | Гликозилированный | ||
| 59 | 59 | – | GP59, 57 | Гликозилированный | |
| 51 | 50 | 51 | 52 | ДНК-связывающий белок | Фосфорилированный, мажорный, ядерный |
| 40 | 41 | 39 | 42 | Белок вириоиа | |
| 38 | 37 | 39 | 39 | ||
| 37 | 37 | 38 | 35 | Белок сборки | Мажорный, фосфорилированный, локализуется в В-капсидах |

3.2 Титрование вируса
HVS в соответствующих разведениях обычно титруют на монослое клеток Vero или ОМК, растущих в 25 см2 пластиковых флаконах с плоским дном. Вирус титруют методом бляшек. Необходимо отметить, что некоторые партии телячьей сыворотки ингибируют формирование бляшек в культурах ОМК. Во избежание этого сыворотку выдерживают 30 мин при 56°С.
1. Адсорбируют аликвоты соответствующих разведений вируса объемом 1 мл 1–2 ч при 37°С.
2. Аликвоты заменяют на культуральную среду, содержащую 2% ТС и 0,5% КМЦ.
3. Через 7–10 дней инкубации при 37°С начинают формироваться мелкие бляшки. Через 14 дней диаметр бляшек достигает 2–3 мм, хотя, конечно же, данный признак специфичен для каждого штамма.
Немного раньше бляшки формируются в монослойных первичных культурах мармозеток. На рис. 13 показана морфология бляшек HVS через 6 и 9 дней после начала инфекции.
3.3 Цикл размножения
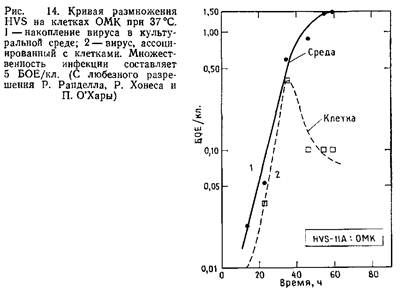
Обычно для получения кривых роста в культуры вносят вирус с высокой множественностью инфекции, а затем через короткие промежутки времени собирают вирус. Таким образом, получают кривую роста HVS. Однако интерпретировать полученные результаты следует с осторожностью. Рэн-делл и Хонес показали, что в этих условиях во многих клетках задерживается инициация вирусной репликации. Если это действительно так, то цикл размножения HVS в одной инфицированной клетке может завершиться за 18 ч.
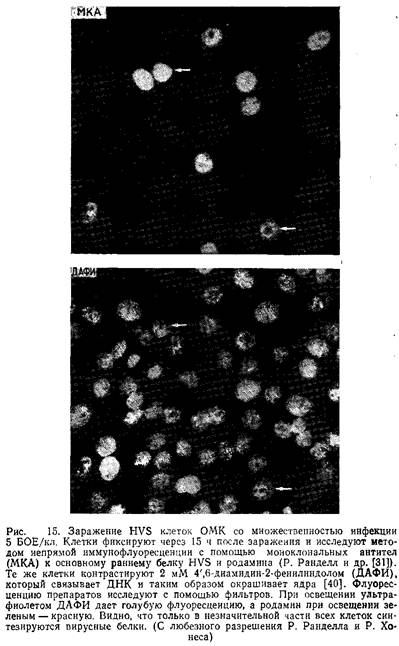
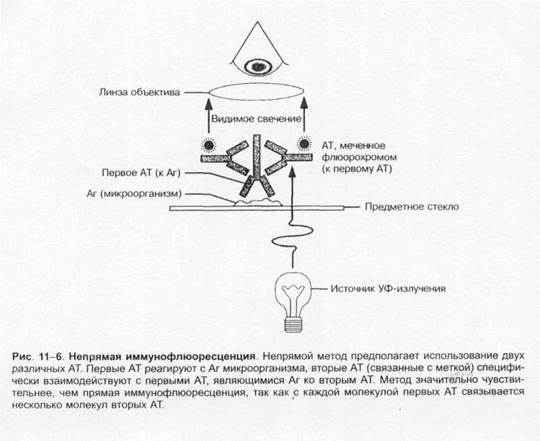
Возможно, что репликация вируса зависит и от клеточного цикла. Эти сложные исследования велись с помощью иммунофлуоресценции на основе моноклинальных антител к антигенам зараженных клеток.
3.4 Получение очищенного вируса
1. Монослойные культуры, выращиваемые в роллерных флаконах, инфицируют с низкой множественностью инфекции, как описано выше. Через 4–5 дней вирус осаждают из культуральной среды центрифугированием при 25000 об/мин 30 мин в роторе SW27. При необходимости через 2 дня после заражения вносят радиоактивную метку.
2. Осадок ресуспендируют в соответствующем буфере. Полученную суспензию по возможности следует оставить на ночь при 4°С.
3. Суспендированный осадок наслаивают на градиент глицерина или сахарозы и центрифугируют при 19000 об/мин 20–30 мин в роторе SW27. После центрифугирования при просмотре пробирок в рассеянном свете обнаруживается одна полоса в центре градиента.
4. Фракцию, состоящую более чем на 90% из вирусных частиц, имеющих оболочку, отбирают, центрифугируют 1 ч при 25000 об/мин и ресуспендируют в соответствующем буфере.
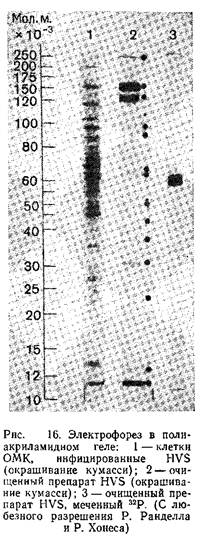
В результате первого градиентного центрифугирования получают осадок, содержащий большое количество вируса. Осадок можно ресуспендировать и дополнительно очистить вторым градиентным центрифугированием. Фракции очищенного вируса могут быть использованы для определения концентрации белка, количества физических частиц и инфекционного титра. Для исследования вирусных частиц электрофорезом в полиакриламидном геле вирус разрушают, как описано выше для ВПГ. Спектр структурных полипептидов HVS штамма 11 показан на рис. 16.
Похожие работы
... , жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах. Микробиологические методы Микробиологические методы — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт наличия возбудителя в исследуемом материале. Идентификацию чистых культур ...
... фагами, либо путем выталкивания участков цитоплазмы, либо, наконец, путем выхода отдельных вирионов или небольших их групп. Некоторые вирусы животных с трудом освобождаются из клеток в культурах in vitro; в живом организме выходу таких вирусов из клеток и их распространению способствует захват поврежденных вирусом клеток фагоцитами и их переваривание. Вирусы растений обычно не освобождаются путем ...
... часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей ...
... через 13, перманганат калия 1 : 1000 через 10 мин. Микроб очень чувствителен к антибиотикам тетрациклинового ряда, в меньшей степени — к пенициллину и синтомицину, устойчив к мицелину и колимицину. Эпизоотология. В естественных условиях болеют овцы независимо от возраста, пола и породности. Из лабораторных животных чувствительны кролики и белые мыши, менее восприимчивы морские свинки, голуби. ...
0 комментариев