Навигация
КДа, диализовали против 5 мМ Tris-HCl, pH 7.4
Диализат наносили на вторую колонку с DEAE-целлюлозой (высота 1 см, объем 1 мл).
Смывали белки таким же градиентом по два объема колонки.
Фракции после первой и второй колонки проверяли на приборе для определения проводимости бислойных липидных мембран (БЛМ).
2.1.6. Определение проводимости бислойных липидных мембран (БЛМ)
Электрическая часть прибора для измерения проводимости бислойных липидных мембран представляет собой амперметр, измеряющий силу тока при определенной разности потенциалов между электродами. Сила тока зависит от проницаемости (сопротивления) мембраны, разделяющей раствор электролита в кювете. Исходя из этого, можно определить проводимость мембраны (проводимость = 1/ сопротивление).
Проводимость билипидного слоя очень близка к нулю (10-12 пСм) при умеренном напряжении. Абсолютное значение напряжения более 150 мВ «рвет» билипидный слой.
Проводимость отличная от нуля определяется белками, встроенными в билипидный слой.
Проводимость нелинейно зависит от напряжения (в случае БЛМ), поэтому определяется проводимость при различных напряжениях.
Подготовка кювет: до и после работы кюветы отмывали детергентами, затем 10-15 минут споласкивали в струе воды (в стакане). Промывали дистиллятом, протирали спиртом, промывали дистиллятом от спирта. Ставили сушиться. Когда кюветы высыхали, смазывали отверстие в меньшей кювете липидами снаружи и внутри и давали высохнуть. Вставляли меньшую кювету в большую. Наливали в каждую кювету по 1 мл среды.
Среда для БЛМ: 3 M KCl; 20 мМ Tris, pH 7.4.
Приготовление липидов: 20 мкл общих липидов мозга и 26 мкл кардиолипина (Blight et al., 1959). Смесь близка по составу к митохондриальным липидам.
Затем эту смесь сушили аргоном, чтобы испарился хлороформ и метанол.
В пробирку с высушенными липидами добавляли 80 мкл н-декана, чтобы растворить липиды перемешивали.
Работа на приборе: наливали в каждую кювету по 800 мкл буфера; вставляли два электрода в кюветы; включали приборы; наносили липиды на отверстие в меньшей кювете, используя микроскоп. Ждали, пока цветная (полислойная) мембрана станет черной (бислойной).
В одну из кювет (обычно транс-) добавляли необходимое количество белка, а в другую (цис-) такое же количество среды для БЛМ, причем с расчетом, чтобы содержание KCl в обеих кюветах было изоосмотическим.
В случае появления проводимости, ее регистрировали две-три минуты, затем меняли напряжение, и ингибировали проводимость АТФ.
2.1.7. Нативный электрофорез
При нативном электрофорезе не используются детергенты, белки разделяются как по заряду, так и по молекулярной массе. При обнаружении (возможном) не одной, а нескольких полос (загрязнение) проводится элюция с геля всех полос, затем белки идентифицируются на SDS-форезе.
Концентрированный буфер для элюции (рН=8.8): 3г Tris на 500 мл воды; 14.4 г глицина на 500 мл воды.
Буфер для элюции: концентрированный буфер развести в 10 раз.
Приготовление гелей: сведения представлены в таблице 4.
Таблица 4. Приготовление гелей для нативного электрофореза.
| 10% гель: | 2.5% гель: |
| 30% акриламид – 3.3 мл | 30% акриламид – 0.5 мл |
| 1% бис-акриламид - 1.3 мл | 1% бис-акриламид – 0.5 мл |
| 1.5 М трис (рН=8.7) – 2.5 мл | 0.5 М трис (рН = 6.8) – 1.25 мл |
| вода - 2.73 мл | вода – 2.67 мл |
| персульфат аммония - 0.035 мл | персульфат аммония - 0.025 мл |
| ТЕМЕД – 0.003 мл | ТЕМЕД – 0.0025 мл |
Пластинки заливали рабочим буфером для фореза. Проводили префорез: 30 мА 30 мин.
Бромфеноловый синий в кислой среде бурый, при рН 8.3 синеет. Краску наносили на гель ровным слоем и устанавливали силу тока 30 мА на 1 мин, чтобы краска вошла в гель.
Добавляли сахарозу и глицерин для увеличения плотности раствора. В краску тоже добавляли сахарозу.
Когда краска входила в гель, наносили пробу ровным слоем. Устанавливали силу тока 30 мА (примерно на 3 часа).
После этого, вырезали боковые части геля, окрасили их 30 минут бромфеноловым синим, отмывали в 7.5% уксусной кислоте. Вырезали полосу геля, соответствующую полосе белка (должна быть чуть шире, чем полоса белка), измельчали, помещали в трубку для элюции.
Пробирки заполняли буфером, потом заливали буфер в верхнюю камеру, чтобы покрыло пробки. В наружной камере буфер должен покрывать мембрану.
Камеру ставили в холодильник, проводили элюцию при 8 мА (для двух трубок) 12 часов. Доэлюцию (если было необходимо) проводили при 10 мА 1 час.
После этого, сливали буфер из внутренней камеры во внешнюю. Из трубок пипеткой вытягивали буфер. Аккуратно снимали пробку – в ней препарат. Осторожно, чтобы не повредить мембрану, вытягивали пипеткой элюат.
Похожие работы
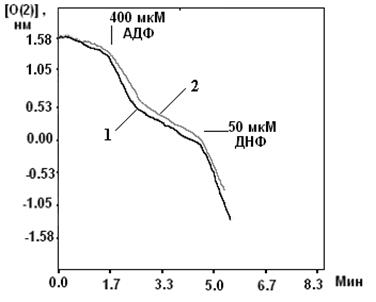
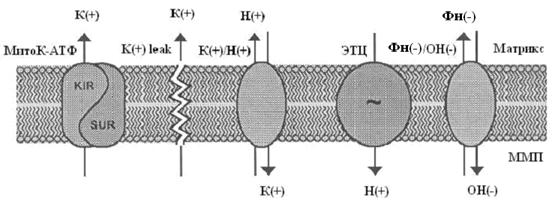
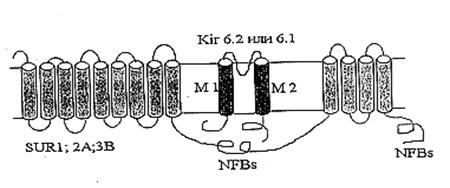
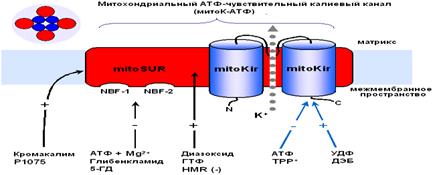
... м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, ...
0 комментариев