Навигация
Концентрирование белка методом обратного диализа с помощью полиэтиленгликоля
2.1.8. Концентрирование белка методом обратного диализа с помощью полиэтиленгликоля
Фракцию помещали в диализный мешочек (его можно ставить вертикально, тогда ПЭГ должен покрывать мешочек на 1/3). Мешочек клали в бюкс или чашку Петри и засыпали ПЭГ.
2.2. Выделение митохондрий из печени крыс
Среда выделения (200 мл, рН 7.4): маннитол 210 мМ; сахароза 70 мМ; HEPES (N-2-гидроксиэтилперазин–N’-этансульфоновая кислота) 10 мМ. Среду разделяли на три части. В одну 37 мг ЭДТА на 100 мл среды, в другую 45 мкл 0,1 М ЭГТА на 100 мл среды. Третью (три миллилитра) оставляли без изменений.
Все процедуры проводили при 4 °С. Взвешенный физраствор предварительно охлаждали. Затем взвешивали вместе с печенью. Измельчали печень в прессе, затем гомогенизировали, разбавив средой с ЭДТА в девять раз.
Центрифугировали 4 мин при 250 g, затем 6 мин при 600 g. В результате этого осаждались ядра и обрывки мембран.
Супернатант центрифугировали 20 мин при 4500 g.
Осадок ресуспендировали в среде с ЭГТА и центрифугировали 20 мин при 4500 g.
Осадок ресуспендировали в среде без ЭГТА и без ЭДТА в соотношении 100 мкл среды на каждый грамм ткани и ставили в лед.
2.4. Выделение митохондрий из сердца крыс
Среда выделения (150 мл, рН 7.4): сахароза 70 мМ; маннитол 210 мМ; хепес 10 мМ; ЭГТА 2 мМ. Среду разделяли на три части. В одну (10 мл) добавляли 1 мг протеазы (непосредственно перед выделением). В другую (70 мл) - добавляли 140 мг БСА. В третью (70 мл) ничего не добавляли.
Все процедуры проводили при 4 °С.
Сердце помещали в предварительно охлажденный физраствор и взвешивали. Затем клали сердце в среду с протеазой на 10 минут, измельчая сердце ножницами. Через 10 минут часть жидкости сверху сливали, чтобы удалить частички жира и связки. Далее разводили средой с альбумином в 9 раз и гомогенизировали.
Гомогенат центрифугировали пять минут при 650g (осаждаются ядра и обрывки мембраны).
Супернатант центрифугировали 10 мин при 8000g.
Осадок ресуспендировали в среде без альбумина, центрифугировали 10 минут при 8000g.
Осадок вновь ресуспендировали в среде без альбумина из расчета 0.1 мл среды на 1г ткани сердца и ставили в лед.
2.5. Определение параметров транспорта К+ с помощью
К+ -селективного электрода
Ион-селективные электроды позволяют определять концентрацию ионов в растворе, которая зависит от разности потенциалов, возникающей между электродом и электродом сравнения.
Среда для К+ - электрода (рН 7.2-7.4): Сахароза 150 мМ; Трис(гидроксиметил)метиламин 10 мМ; NaH2PO4 5 мМ. Использовали прибор «Record 4».
Калибровали шкалу.
В ячейку добавляли: 1 мл среды; модуляторы каналов, ингибиторы цепи и т. п.; митохондрии; ДНФ (5 мкл); triton x-100 (5 мкл, 10%).
После измерений кювету промывали.
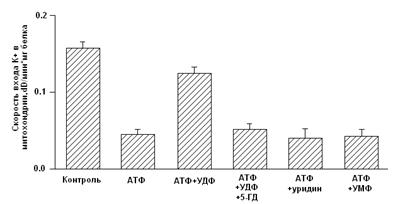
Определяли скорость выхода ионов калия и его количество в митохондриях.
Пересчитывали скорость выхода калия и его количество на милиграмм белка митохондрий.
2.6. Определение параметров дыхания с помощью кислородного электрода Кларка
Среда для электрода (рН 7.4): 150 мМ сахароза; 50 мМ хлорид калия; 5 мМ дигидрофосфат натрия; 0.5 мМ хлорид магния; 10 мМ хепес. Использовали прибор «Record 4».
Калибровку шкалы выполняли по двум точкам. «Ноль» нмоль кислорода устанавливали при добавлении дитионита натрия (несколько мкг), так как дитионит является сильным восстановителем. 250 нмоль кислорода соответствует содержанию кислорода в среде дыхания объемом 1 мл.
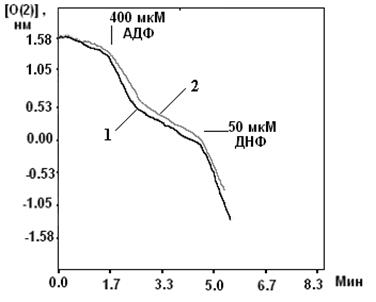
В ячейку добавляли 1 мл среды. 1 мМ Rotenon, 5 мМ сукцинат, митохондрии, 200 мкМ АДФ, ДНФ (5 мкл).
Программа автоматически рассчитывает скорость дыхания.
Скорости: до добавления АДФ, после добавления АДФ, после фосфорилирования АДФ, после добавления разобщителя измеряли на самом прямом участке.
Пересчитывали скорость дыхания на миллиграмм белка митохондрий.
2.7. Спектрофотометрическое определение скорости
набухания митохондрий
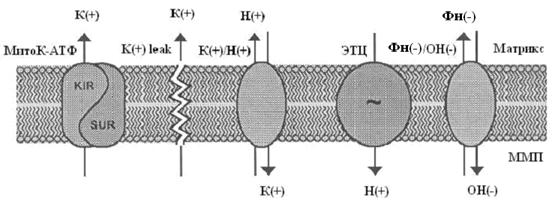
Потенциал-зависимый вход ионов К+ в митохондрии вызывает вход осмотически облигатной воды, что ведет к набуханию и увеличению оптической плотности.
Среда для набухания: КCl 50 mM; NaH2PO4 5 mM; MgCl2 0.5 mM; Hepes 5 mM; EGTA 100 мкM.
В кювету добавляли: 5 мкМ цитохром С - 4 мкл; 1 мМ Rotenone (если в качестве субстрата сукцинат) – 10 мкл; 2 мл среды; модуляторы, активные вещества, и. т. п; митохондрии.
Использовали метод динамического определения оптической плотности при длине волны 520 нм, установив время измерения равное трем минутам. Через полторы минуты добавляли субстрат (сукцинат или малат с глутаматом). По окончании измерения данные сохраняли в Excel и рассчитывали изменение оптической плотности в минуту на милиграмм белка митохондрий.
Похожие работы
... м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, ...
0 комментариев