Навигация
Изучение параметров АТФ-зависимого транспорта
3.3. Изучение параметров АТФ-зависимого транспорта
ионов калия в митохондриях
Исследование параметров проводилось на двух моделях:
А) Модель энергозависимого набухания митохондрий.
Увеличение концентрации ионов К+ матриксе провоцирует осмотически облигатное поступление воды и, следовательно, набухание митохондрий. Изменение объема митохондрий влияет на их оптическую плотность. Следовательно, активность канала можно определить методом динамической спектрофотометрии.
Скорость энергозависимого входа ионов К+ определялась у крыс с различной устойчивостью, а также адаптированных к гипоксии крыс. Данные представлены в таблице 6.
Из полученных данных следует, что скорость энергозависимого транспорта К+ значительно выше у высокоустойчивых и адаптированных к гипоксии крыс по сравнению с низкоустойчивыми животными.
| Субстрат | Показатель | НУ | А | ВУ |
| Сукцинат | Скорость, DD/мин*мг белка МХ | 0.452+0.074 | 0.566+0.146 | 0.626+0.122 |
| Малат + глутамат | Скорость, DD/мин*мг белка МХ | 0.339+0.032 | 0.548+0.038 | 0.537+0.156 |
Таблица 6. Энергозависимый вход калия в митохондрии печени животных с различной устойчивостью к гипоксии, а также адаптированных к гипоксии животных.
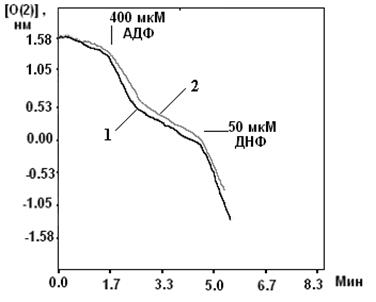
Б) Модель энергозависимого набухания митохондрий.
При сильном разобщении митоК+АТФ способен опосредовать выход ионов К+ из матрикса, то есть обращать свою работу, наблюдаемую в физиологических условиях. Показано, что эта активность ингибируется АТФ, что доказывает специфичность выхода ионов К+ в данной модели именно через этот канал.
Скорость выхода катионов К+ определялась у всех групп крыс.
Данные полученные на модели ДНФ-индуцируемого выхода ионов К согласуются с данными, полученными на модели энергозависимого набухания митохондрий. То есть, указывают на изначально большую активность канала у высокоустойчивых крыс и повышение активности канала при адаптации. Данные представлены в таблице 7.
Таблица 7. Скорость ДНФ-индуцируемого выхода К+ из митохондрий печени животных с различной устойчивостью к гипоксии, а также адаптированных к гипоксии животных.
| Животные | Скорость, мкМ / мин*мг белка митохондрий | Скорость после добавления 800 мкМ АТФ, мкМ / мин*мг белка |
| А | 73.256±3.54 | 3,782±3.211 |
| ВУ | 70,02±3.76 | 6,18±3.742 |
| НУ | 42,309±3.86 | 3,537±2.349 |
3.4. Определение количества ионов К+ в митохондриях
различных групп крыс
Количество калия измеряется К-селективным электродом после добавления в среду тритона Х-100. Полученные данные представлены в таблице 8.
Таблица 8. Количество ионов калия в митохондриях печени животных с различной устойчивостью к гипоксии, а также адаптированных к гипоксии животных.
| Животные | Количество К+, мкМ / мг суммарного белка митохондрий |
| А | 73,85±3.654 |
| ВУ | 112,29±3.322 |
| НУ | 63,37±3.782 |
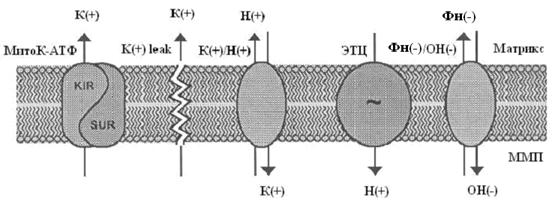
Исследования показали, что концентрация калия в МХ высокоустойчивых и адаптированных крыс ниже, чем у низкоустойчивых животных. Полученные данные указывают, что адаптация ведет не только к активации митохондриального АТФ-чувствительного калиевого канала, но и системы выброса калия из митохондрий, осуществляемого, обычно, К+/Н+-обменником. Таким образом, при адаптации активируется калиевый цикл в митохондриях.
Известно, что активация калиевого цикла, способствует слабому разобщению митохондрий, которое ведет к снижению мембранного потенциала. Согласно данным, обсуждаемым в обзоре, незначительное снижение мембранного потенциала ведет к существенному уменьшению продукции супероксиданиона [34]. Таким образом, митоК+АТФ участвует в регуляции образования АФК в митохондриях.
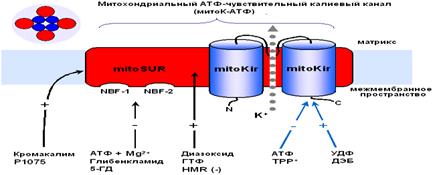
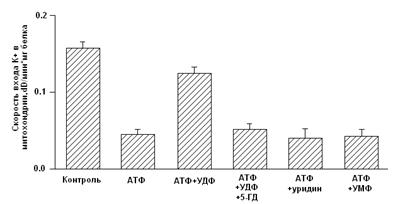
Недавно был обнаружен эффективный природный метаболический активатор митоКАТФ – уридин-5’-дифосфат (УДФ) [42]. Показано, что УДФ, а также УМФ и уридин обладают кардиопротекторными свойствами [9,40]. Использование метаболического активатора канала в качестве лекарственного средства будет иметь ряд преимуществ, по сравнению с их синтетическими аналогами, поскольку их концентрацию в клетке можно регулировать, и они не обладают побочными эффектами, присущими лекарственным препаратам.
Выводы
1. Выделен белок с молекулярной массой 55 кДа, являющийся канальной субъединицей митоКАТФ, изучены его некоторые физико-химические свойства.
2. При адаптации к гипоксии уменьшается скорость дыхания и окислительного фосфорилирования в митохондриях, независимо от присутствия или отсутствия К+ в среде.
3. Показано, что скорость как ДНФ-индуцированного выхода, так и энергозависимого входа ионов К+ в митохондрии выше у высокоустойчивых крыс по сравнению с низкоустойчивыми и повышается при адаптации.
4. Количество ионов К+ в митохондриях у высокоустойчивых ниже, а у адаптированных существенно ниже, чем у низкоустойчивых.
Список литературы
1. Лукьянова Л. Функционально-метаболические особенности животных с различной индивидуально резистентностью к гипоксии. // Проблемы гипоксии: молекулярные, физиологические и медицинские аспекты. - 2004, с. 156-170
2. Миронова Г., Маслова Т., Федотчева Н., Миронов Г. Эволюционные аспекты гипобиоза и зимней спячки. - Л., Наука; 1986; 64-68.
3. Миронова Г., Скарга Ю., Григорьев С. и др. АТР-зависимый калиевый канал митохондрий печени крысы. I. Выделение, очистка и реконструкция канала в БЛМ.// Биологические мембраны -1996; Т.13, № 4: 396-404.
4. Миронова Г., Федотчева Н., Макаров П., Проневич Л., Миронов Г.П. Белок из митохондрий сердца быка, индуцирующий канальную калиевую проводимость бислойных липидных мембран. // Биофизика, 1981 - 26(3): 451-457.
5. Сазонтова Т.Г., Архипенко Ю.В. Роль свободнорадикальных процессов в адаптации организма к изменению уровня кислорода// Проблемы гипоксии, 2004 – С. 112-138.
6. Скарга Ю.Ю., Долгачёва Л.П., Федотчева Н.И, Миронова Г. Влияние антител к митохондриальному К+-транспортирующему белку на транспорт К+ в митохондриях печени крысы. // Укр. Биохим. Журнал - 1987 - 59(6): 54-59.
7. Aguilar-Bryan L., Nichols C., Wechsler J. et al. Cloning of the beta cell high-affinity sulfonylurea receptor: a regulator of insulin secretion.// Science – 1995 - 268: 423-426.
8. Alekseev A.E., Brady P.A., Terzic A. Ligand-insensitive state of cardiac ATP-sensitive K+ channels. Basis for channel opening. //J. Gen. Physiol., 1998 - 111: 381-394.
9. Aussedat J, Ray A, and Rossi A. Uridine Incorporation in normal and ischaemic perfused rat heart.// Mol. Physiol, 1984 - 6: 247-56.
10. Bajgar R., Seetharaman S., Kowaltowski A.J., Garlid K.D., Paucek P. Identification and properties of a novel intracellular (mitochondrial) ATP-sensitive potassium channel in brain. //J. Biol. Chem. -2001 - 276: 33369-33374.
11. Beckman K., Ames B. Mitochondrial aging: open questions.// Ann. NY Acad.Sci. - 1998 - V 854. p 118-128.
12. Bednarczyk P., Dolovy K., Szewczyk A. Matrix Mg2+ regulates mitochondrial ATP-dependent potassium channel from heart.// FEBS., 2005 - 579: 1625-1632.
13. Bhattacharyya D. Purification and functional characterization of a low-molecular-mass Ca2+,Mg2+- and Ca2+-ATPase modulator protein from rat brain cytosol// Biochem. J – 1998 vol 330 p 95- 101
14. Chaves E., Yung D., Brierley G. Energy-dependent exchange of K+ in heart mitochondria, K+ efflux. Arch. Bioch. //Biophys. 1977 - 183: 460-470.
15. Dahlem Y., Horn T., Butinas L., Gonoi T., Wolf T., Siemen D. The human mitochondrial KATP channel is modulated by calcium and nitric oxide: a patch-clamp approach.// Biochеm. Biophys. Acta., 2004 - 1656: 46-56.
16. D’Hahan N., Moreau C., Prost A., Jacquet H., Alekseev A., Terzic A., Vivaudou M. Pharmacological plasticity of cardiac ATP-sensitive potassium channels toward diazoxide revealed by ADP. // Proc Natl Acad Sci U S A, 1999 - 96: 11962–11967.
17. Diwan J.J., Haley T., Sanadi D.R. Reconstitution of K+ transport with 53 kDa mitochondrial protein.// Biochem Biophys Res Commun., 1988 - 153: 224–230.
18. Fedotcheva N.I., Sharichev A.A., Mironova G.D., Kondrasheva M.N. Inhibition of succinate oxidation and K+ transport in mitochondria during hibernation. Comp.// Biochem. Physiol, 1985 - 82B: 191-195.
19. Ferranti R., Da Silva M., Kowaltowski A. Mitochondrial ATP-sensitive K+ channel opening decreases reactive oxygen species generation. // FEBS Lett., 2003 - 536(1-3): 51-5.
20. Fikret E., Guido M., Gassanov N. et al. Testosterone induces cytoprotection by activating ATP-sensitive K+ channel in the cardiac mitochondrial inner membrane.// Circulation, 2004 - 110(19): 3100-3107.
21. Flohe L. et al. Redox regulation of NF-kappa B activation//Free rad biol med –1997 – vol 22 – p 1115 –1126.
22. Forbes R.A., Steenberger C., Murphy E. Diazoxide-induced cardioprotection requires signaling through a redox-sensitive mechanism.// Circ. Res. – 2001 - 88: 802-809.
23. Garlid K.D., Paucek P., Yarov-Yarovoy V. et al. Cardioprotective effect of diazoxide and its interaction with mitochondrial ATP-sensitive K+ channels: possible mechanism of cardioprotection.// Circ. Res.- 1997 - 81: 1072-1082.
24. Garlid K. Unmasking the mitochondrial K/H exchanger: tetraethylammonium-induced K+ loss.// Biochem. Biophys. Res. Commun.- 1979 - 87(3): 842-7.
25. Garlid K.D., Beavis A.D. Evidence for the existence of an inner membrane anion channel in mitochondria.// Biochеm. Biophys. Acta – 1986 - 273: 13578-13582.
26. Garlid K. Peter Mitchell, 1920-1992.// J Bioenerg. Biomembr.- 1992 - 24(5): 515-6.
27. Garlid K.D., Paucek P. The mitochondrial potassium cycle.// IUBMB Life.-2001- 52: 153-158.
28. Graven, K. K., L. H. Zimmerman, E. W. Dickson, G. L. Weinhouse, and H. W. Farber. Endothelial cell hypoxia associated proteins are cell and stress specific.// J. Cell. Physiol.- 1993 - 157: р. 544-554
29. Grigoriev S., Skarga Y.Y., Mironova G.D., Marinov B.S. Regulation of mitochondrial KATP channel by redox agents.// Biochim. Biophys. Acta., 1999 - 1410(1): 91-96.
30. Grover G., Garlid K. ATP-sensitive potassium channels: a review of their cardioprotective pharmacology.// J.Mol.Cell Cardiol., 2000 - 32: 677-695.
31. Inoue I., Nagase H., Kishi K. & Higuti T. ATP-sensitive K+ channel in the mitochondrial inner membrane.// Nature - 1991 - 352: 244-247.
32. Kaplan-Bresler A. Metmyoglobin oxidation during electro transport reactions in mitochondria. // J.Gen.Physiol. - 1965 - 48: 685-98.
33. Kondrashova M., Mironova G. Oxygen requirements for ADP phosphorylation under conditions of cyanide block.// Biokhimia, 1971 - 36(4): 864-865.
34. Korshunov S., Skulachev V., Starkov A. High protonic potential actuates a mechanism of production of reactive oxygen species in mitochondria.// FEBS Letters 416 - 1997 – р. 15-18.
35. Krenz M., Oldenburg O., Wimpee H. et al. Opening of ATP-sensitive potassium channels causes generation of free radicals in vascular smooth muscle cells.// Basic Res. Cardiol. – 2002 - 97: 365-373.
36. Lacza Z., Snipes J., Kis B., Szabo C., Grover G., Busija D. Investigation of the subunit composition and the pharmacology of the mitochondrial ATP-dependent K+ channel in the brain.// Brain Res. – 2003 - 994: 27-36.
37. Li X.Q., Hegazy M.G., Mahdi F. et al. Purification of f reconstitutively active K+/H+ antiporter from rat liver mitochondria.// J. Biol. Chem. - 1990 - 265: 15361-15322.
38. Liaudet L., Soriano F., Szabo C. Biology of nitric oxide signaling. // Crit.Care Med – 2000 - 28: N37-N52.
39. Lu Ch., Halvorsen S. Channel activators regulate ATP-sensitive potassium channel (KIR6.1) expression in chick cardiomyocytes.// FEBS Lett. – 1997 - 412: 119-125.
40. Matsushita S, Fanburg B. Pyrimidine nucleotide synthesis in the normal and hypertrophying rat heart. Relative importance of the de novo and “salvage” pathways.// Circ. Res. – 1970 - 27: 415-28.
41. Maulic N., Goswami S., Galang N., Das D. Differential regulation of Bcl-2, AP-1 and NF-kappaB on cardiomyocyte apoptosis during myocardial ischemic stress adaptation.//FEBS Lett. – 1999 – vol. 443 p. 331-336
42. Mironova G., Negoda A., Marinov B., Paucek P., Costa A., Grigoriev S., Skarga Yu., Garlid K. Functional distinctions between the mitochondrial ATP-dependent K+ channel (mito KATP) and its inward rectifier subunit (mitoKIR).// JBC - 2004 - 279(31): 32562-32568.
43. Mironova G.D., Skarga Yu.Yu., Grigoriev S.M., Negoda A.E., Kolomytkin O.V., Marinov B.S. Reconstitution of the mitochondrial ATP-dependent potassium channel into bilayer lipid membrane.// J. Bioenerg. Biomembr. – 1999 - 31(2): 157-161.
44. Mitchel P. Coupling of phosphorylation to electron and hydrogen transfer by a chemiosmotic type of mechanism.// Nature – 1961- 191: 144-148.
45. Nakae Y., Kwok W.M., Bosnjak Z.J., Jiang M.T. Isoflurane activates rat mitochondrial ATP-sensitive K+ channels reconstituted in lipid bilayers.// J. Physiol. Heart Circ. Physiol. – 2003 - 284: 1865-1871.
46. Noma А. ATP-regulated K+ channels in cardiac muscle.// Nature – 1983 - 305: 147-148.
47. Notsu T., Ohhashi K., Tanaka I., Ishikawa H., Niho T., Fukutake K., Mizota M. 5-Hydroxydecanoate inhibits ATP-sensitive K+ channel currents in guinea-pig single ventricular myocytes.// Eur. J. Pharmacol.- 1992 - 220: 35 - 41.
48. Ohnishi S.T., Ohnishi T., Muranaka S. et al. A possible site of superoxide generation in the complex I segment of rat heart mitochondria.// J. Bioenerg. Biomembr. – 2005 - 37 (1): 1-15.
49. Ohno-Shasaku T., Kubota T., Yamaguchi J. et al. Reciprocal effects on Ca2+ and Mg-ATP on the “run-down” of the K+ channels in the opossum kidney cells.// Pflugers Arch.- 1989 - 413: 562-564.
50. Oldenburg O., Cohen M.F., Downey J.M. Mitochondrial KATP channels in preconditioning.// J Mol. Cell. Cardiol. – 2003 - 35: 569-575.
51. O’Rourke B. Evidence for mitochondrial K+ channels and their role in cardioprotection.// Circ.Res. – 2004 - 94: 420-432.
52. Paradies G., Petrosillo D., Pistolese M. et al. Decrease in mitochondrial complex I activity in ischemic/reperfused rat heart: involvement of reactive oxygen species and cardiolipin.// Circ. Res. – 2004 - 94: 53-59.
53. Paucek P., Mironova G., Mahdi F., Beavis F., Woldegiorgis G., Garlid K.D. Reconstruction and partial purification of the glibenclamide-sensitive, ATP-sensitive K+ channel from rat liver and beef heart mitochondria.// J. Biol. Chem.- 1992. - 267(36): 26062-26069.
54. Raha S., Robinson B. Mitochondria oxygen free radicals and apoptosis// American Journal of Medical genetics - 2001- V.106 p. 62-70.
55. Rajesh K., Sasaguri S., Zhitian Z. et al. Second window of ischemic preconditioning regulates mitochondrial permeability transition pore by enhancing Bcl-2 expression.// Cardiovasc. Res. – 2003 - 59: 297-307.
56. Rottenberg H., Solomon A.K. Energy linked K+ uptake in mitochondria.// Biochem. Biophys Res. – 1965 - 20: 85-92.
57. Sasaki N., Sato T., Ohler A., O’Rourke B., Marban E. Activation of mitochondrial ATP-dependent potassium channels by nitric oxide.// Circulation – 2000 - 101: 439-445.
58. Sato T, Sasaki N, O’Rourke B, Marbán E. Nicorandil, a potent cardioprotective agent, acts by opening mitochondrial ATP-dependent potassium channel.// J. Am. Coll. Cardiol. – 2000 - 35: 514–518.
59. Schild L.R.T., Reiser M., Horn T.F., Wolf G. et al. Nitric oxide produced in rat liver mitochondria causes oxidative stress and impairment of respiration after transient hypoxia.// FASEB J. – 2003 - 17: 2194-2201.
60. Sheffer I. A century of mitochondrial research: achievements and perspectives// Mitochondrion – 2001 – V. 1 N.1 p. 3-31.
61. Tsai C., Su S., Chou T., Lee T. Differential effects of sarcolemmal and mitochondrial KATP channels activated by 17b-estradiol on reperfusion arrhythmias and infarct sizes in canine hearts.// J. Pharmacol. Exper. Therap. – 2002 - 301: 234-240.
62. Tucker S.J., Gribble F.M., Zhao C., Trapp S. and Ashcroft F.M. Truncation of Kir6.2 produces ATP-sensitive K+ channels in the absence of the sulphonylurea receptor.// Nature – 1997 – 387, p. 179-183.
63. Ungemach F.R. Free radicals liver injury.// Proc. Int. Meet., (Turin, June 27-29, 1985) - Oxford, Washington DC, - 1985. – P 127-134
64. Zhang D., Chen Y., Campbell W., Zou A., Gross G., Li P. Characteristics and suproxide-induced activation of reconstituted myocardial mitochondrial ATP-sensitive potassium channel.// Circ. Res. – 2001 - 89: 1177-1173.
65. Zhu H., Dong J., Zhu W., Ding H., Zhou Z. ATP-dependent potassium channels involved in cardiac protection induced by intermittent hypoxia against ischemia/reperfusion injury. // Life Sci. – 2003 - 73: 1275-1287.
Похожие работы
... м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, ...
0 комментариев