Навигация
Методы исследования
2.2 Методы исследования
2.2.1 Методика приготовления питательных сред для культивирования микроорганизмов
Мясопептонный агар (МПА)
При культивировании микроорганизмов большое значение имеет обеспечение их соответствующим питанием. Белковой основой для всех сред является питательный бульон. Основой для приготовления мясопептонного бульона (МПБ) является мясная вода. Ее приготавливают следующим образом: 15 г. сухого бульона растворяли в 1 дм3 дистиллированной воды и кипятили 1–3 мин. Для приготовления плотной питательной среды МПА к 1 дм3 МПБ добавляют 2–2,5% агар-агара от объема среды и расплавляют в автоклаве.
Синтетическая среда
К 1 дм3 дистиллированной воды для удовлетворения потребности микроорганизмов в макро- и микроэлементах, без которых клетка расти не может, в синтетическую среду вводили соли следующего состава (г/дм3): NaH2PO4-1,0; NH4NO3-1,0; KCl – 0,5; MgCl2-0,1. В качестве источника углерода в конструктивном и энергетическом обмене использовали шерстный жир в количестве 1 г/дм3. Также добавляли СПАВ – 1 г/дм3 и агар-агар в количестве 2–2,5% от объема жидкой среды и автоклавировали.
2.2.2 Выделение чистой культуры
Приготовление разведений. Разведения делают в стерильной водопроводной воде. Готовят определенный объем этого раствора и стерилизуют при 1 атм в автоклаве. В ходе одного опыта пользуются постоянным коэффициентом разведения, т. к. в этом случае уменьшается вероятность ошибки. Чаще всего делают десятичные разведения. Для этого берут пробирку с 10 см3 стерильного раствора и переносят стерильной пипеткой 1 см3 исследуемого материала в данную пробирку. Суспензию этого разведения тщательно перемешивают с помощью новой стерильной пипетки, вбирая в пипетку и выпуская из нее полученную смесь несколько раз. Это обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл полученного разведения и переносят его во 2-ую пробирку. Таким образом, готовят и последующие разведения. Степень разведения определяется предполагаемым количеством микроорганизмов в образце и соответственно число разведений тем больше, чем больше микроорганизмов в исходном субстрате.
Для приготовления каждого разведения обязательно используют отдельную пипетку. Пренебрежение этим правилом может привести к получению ошибочного результата. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при приготовлении соответствующего разведения. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведений, что и явится причиной получения завышенного результата.
Посев на агаризованные среды в чашки Петри. В стерильные чашки Петри наливают расплавленную на кипящей водяной бане агаризованную среду, по 20–30 см3 в каждую. Чашки оставляют на горизонтальной поверхности, пока не остынет агар. Для посева отбирают чашки, среда в которых осталась стерильной. Когда используют элективные среды или выделяют и учитывают микроорганизмы, требующие повышенной влажности, посев проводят сразу же или вскоре после застывания агара.
Посев делают из определенных разведений в зависимости от предполагаемого количества микроорганизмов в исследуемом субстрате. Стерильной пипеткой наносят определенный объем (обычно 0,05; 0,1 или 0,2 мл) соответствующего разведения, предварительно тщательно перемешанного, на поверхность агаровой пластинки в чашки Петри. Этот объем распределяют по поверхности среды стерильным шпателем. Затем этим же шпателем проводят по всей поверхности во второй чашке, куда посевной материал не вносили. При выявлении микроорганизмов, количество которых в субстрате относительно не велико, посевной материал распределяют по поверхности среды только в одной чашке.
Из каждого исследуемого разведения делают таким образом 2–3 параллельных высева. Для параллельных высевов из одного разведения можно пользоваться одной пипеткой и одним шпателем. Для посевов из разных разведений используют другую стерильную пипетку и другой шпатель. Чашки с засеянными средами помещают в термостат, отрегулированный на определенную температуру, благоприятную для развития выявляемых микроорганизмов.
Подсчет выросших колоний проводят через определенное время после посева, которое зависит от скорости роста выявляемых микроорганизмов на используемой в опыте среде и данной температуре.
Подсчитывают количество колоний, выросших при высеве из определенного разведения на двух (одной) чашки Петри. Результаты параллельных высевов суммируют и определяют среднее число колоний, выросших при высеве из этого разведения. Колонии считают, как правило, не открывая чашки. Для удобства отмечают просчитанную колонию точкой на наружной стороне дна чашки, пользуясь стеклографом или чернилами по стеклу. При большом количестве колоний дно чашки делят на секторы, подсчитывают количество колоний в каждом секторе и результаты суммируют или используют полуавтоматические счетчики.
Похожие работы
... продукции, а значит, дает значительный экономический эффект. 2. Объекты и методы исследования Целью дипломной работы являлось изучение свойств бактериальной суспензии, с последующим применением в подготовительных процессах переработки мехового сырья. Для выполнения эксперимента был составлен сетевой график, представленный на рисунке 1. Применение ферментов в кожевенной и ...
... Охрана окружающей среды Заключение Рисунок 2 – Сетевой график дипломной работы 2.1 Объекты исследования Объектом исследования в дипломной работе являлись микроорганизмы, выделенные из различных природных жиров: нерпичьего (Н), нерпичьего, выращенного на среде с шёрстным жиром (Нв), шерстного (В) и микроорганизмы, выделенные из ...

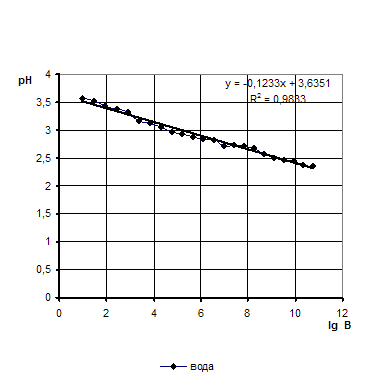
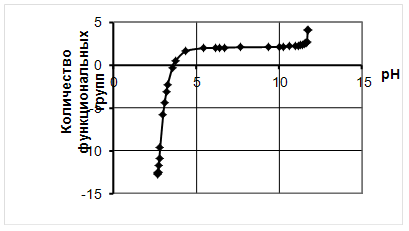
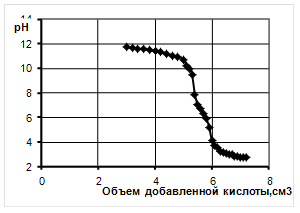
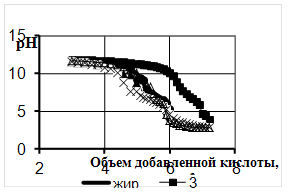


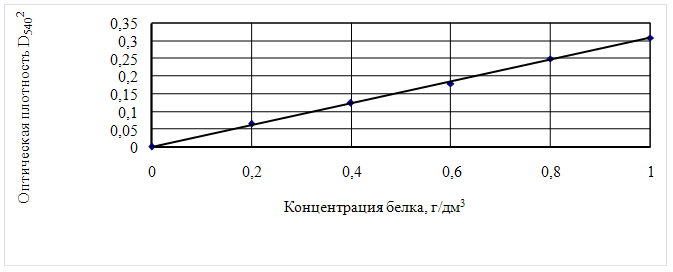
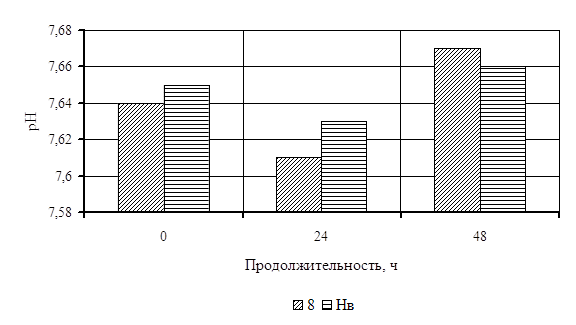
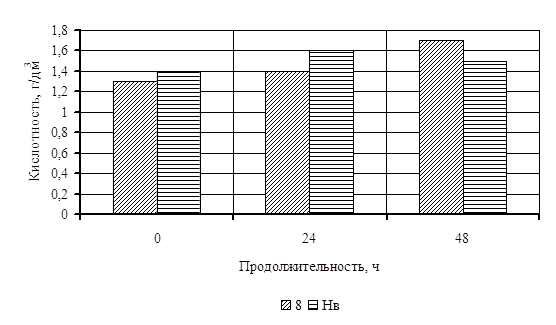
0 комментариев