Навигация
Получение щелочных протеиназ
1.2.2 Получение щелочных протеиназ
1) Ряд авторов под руководством А. Мудерризаде Bacillus sp. выделили алкалофильный штамм Bacillus sp. в летний период из почвы на территории Университета Дикла (Турция) и определили по Берги. Почвенный образей суспензировали в 20 мл дистиллированной воды, инкубировали при 800С 5 мин. Затем 1 мл ресуспензировали в 9 мл дистиллированной воды и по 0,1 мл вносили в питательный агар. Через 72 ч инкубации при 370С отдельные колонии высевали для определения активности щелочной протеазы.
Выделенные культуры выращивали на различных средах. Основная Среда имела следующий состав (г/л): соевая мука 10; крахмал 10; КН2РО4; глюкоза 20; Na2CO3 10; рН 11,5. Культивирование проводили в колбах на 250 мл со 100 мл среды на качалке при 370С 58 ч. После выращивания клетки отделяли центрифугированием, супернатант использовали для очистки фермента. Все этапы очистки проводились при 40С.
Очистка щелочной протеазы. К фильтрату культуральной жидкости, доведенному до рН 11,5, при перемешивании медленно добавляли сульфат аммония до 75% насыщения. Осадок отделяли центрифугированием, растворяли в 20 мл трис-HCl-буфера, рН 8,8, с 50 мМ NaCl и диализовали против 1 л того же буфера в течение ночи. Диализованный фермент наносили на колонку с ДЭАЭ-целлюлозой (3ґ20 см), предварительно уравновешенную 10 мМ натрий-фосфатным буфером, рН 7,6 содержащим 50 мМ NaCl. Активные фракции собирали, затем проводили диализ в 10 мМ фосфатном буфере в течение ночи, затем наносили на колонку с КМ-целлюлозой (2ґ15 см), предварительно уравновешенную тем же буфером. Элюция проводилась линейным градиентам NaCl (200 мл, 0–0,5 М) в том же буфере. Активные фракции объединяли для хранения /37/.
2) МотинаЛ.И., Нахапетян Л.А. /38/, также разработали способ получения щелочной протеиназы. Они получали ее культивированием штамма Вacillus subtilis 72 на жидкой питательной среде следующего состава, %: картофельный крахмал-4; кукурузная мука-1; технический казеин – 0,1; БВК – 0,1; кукурузный экстракт – 0,05; аммоний фосфорнокислый двузамещенный – 0,01; культивирование в лабораторных условиях проводится на круговой качалке, имеющей 240 об/мин, при 400С; начальном рН среды 6,8, в колбах емкостью 750 мл с отбойниками (40 мл питательной среды) в течение 46 ч. Протеолитическая активность составила 10 тыс. ед/мл.
Культуральную жидкость (20 мл), содержащую щелочную протеиназу, наносят на хроматографическую колонку (1,5ґ20 см), наполненную силохромом С-80, модифицированным триэтоксилилмасляной кислотой (n=2, R-H–; 0,42 мг*экв/г сорбента-содержание карбоксильных групп), уравновешенную 0,005 М фосфатным буфером с рН 6,0. Колонку промывают тем же буфером, при этом выходит основная часть пигмента, клетки продуцента и некоторые сопутствующие белки. Колонку промывают до тех пор, пока поглощение элюата при 280 нм не достигнет фоновых значений (D280Ј0,1). Затем проводят элюцию щелочной протеиназы 0,005 М фосфатным буфером с рН 7,8, содержащим 0,2 М NaCl. Выход фермента по активности составляет 92%. Удельная активность фермента в расчете на белок увеличивается 5,4 раза. Элюат концентрируют методом ультрафильтрации на мембране УАМ-150, затем высушивают лиофильно. Полученный препарат светло-серого цвета имеет активность 1000640 ед/г препарата, содержание белка 530 мг/л. Удельная активность 1888 ед/мг белка.
3) Следующий способ получения щелочной протеазы заключается в следующем. Культуральную жидкость получают выращиванием продуцента Вacillus subtilis 72 на питательной среде следующего состава, %: карфтофельный крахмал-8; кукурузная мука-3; технический казеин-1; БВК – 0,5; кукурузный экстракт – 1,0; аммоний фосфорнокислый двузамещенный – 0,05.
Культивирование проводится на качалке при 240 об/мин, при 400С, начальная рН среды 6,9, в колбах емкостью 750 мл в течение 47 ч. Культуральную жидкость (40 мл) с активностью 12 тыс. ед/мл наносят на хроматографическую колонку (2,5ґ35 см), заполненную силохромом С-80, модифицированным триэтоксисилилундекановой кислотой (n=9; R-H-), уравновешенной дистиллированной водой пока поглощение при 280 нм не достигнет фоновых значений. Затем проводят элюцию щелочной протеиназы 0,05М фосфатным буфером с рН 8,0, содержащем 0,2 М NaCl. Элюат концентрируют методом ультрафильтрации на мембране УАМ-150 и высушивают лиофильно. Получают препарат светло-серого цвета с протеолитической активностью 1056550 ед/г препарата, содержание белка 550 мг/л /39/.
1.3 Микробные липазы
В последние годы для получения различных ферментов находят широкое применение микроорганизмы, которые характеризуются ценнейшими свойствами, обеспечивающими им за короткий цикл развития на доступных питательных средах и в производственных условиях синтез ферментов, необходимых для народного хозяйства /40/.
При этом биосинтез многих гидролаз можно регулировать и осуществлять направленно путем подбора соответствующих условий культивирования, и прежде всего состава питательной среды. Более того, многие микробные ферменты образуются в ответ на действие индуктора, вносимого в питательную среду, причем активность индуцированного фермента в ответ на добавление специфического субстрата возрастает в процессе роста микроорганизма многократно, тогда как на среде без соответствующего индуктора фермент образуется в минимальных количествах /41/.
Особенность микроорганизмов заключается в том, что они способны синтезировать внеклеточные ферменты, активность которых во много раз превышает уровень активности внутриклеточных. Таким образом, при определенных условиях микробная клетка может осуществлять «сверхсинтез». Одним из промышленно важных ферментов, продуцируемых микроорганизмами, являются липазы, которые интенсивно исследуются во всем мире. Липаза – триглицеридгидролаза – фермент, катализирующий гидролиз жиров, широко распространена в природе. Она присутствует в животных и растительных клетках, а также в микроорганизмах. Экспериментальные исследования свидетельствуют о том, что микробные липазы являются ферментами с широкой специфичностью и большим разнообразием свойств. Свойства липаз и характер липолитической активности даже у одного рода можно различно варьировать. Изучение микробных липаз представляет большой теоретический и практический интерес, так как они могут быть использованы при гидролизе разнообразных жировых субстратов /42/.
Похожие работы
... продукции, а значит, дает значительный экономический эффект. 2. Объекты и методы исследования Целью дипломной работы являлось изучение свойств бактериальной суспензии, с последующим применением в подготовительных процессах переработки мехового сырья. Для выполнения эксперимента был составлен сетевой график, представленный на рисунке 1. Применение ферментов в кожевенной и ...
... Охрана окружающей среды Заключение Рисунок 2 – Сетевой график дипломной работы 2.1 Объекты исследования Объектом исследования в дипломной работе являлись микроорганизмы, выделенные из различных природных жиров: нерпичьего (Н), нерпичьего, выращенного на среде с шёрстным жиром (Нв), шерстного (В) и микроорганизмы, выделенные из ...



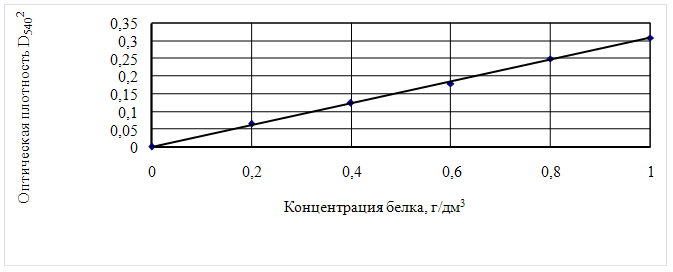
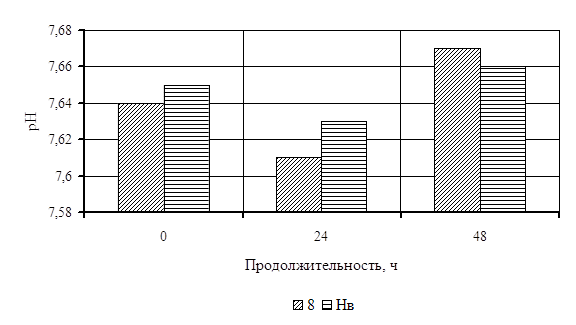
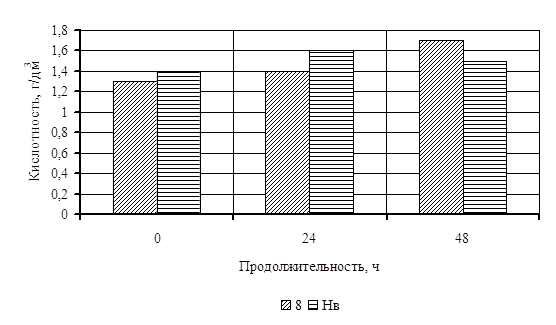
0 комментариев