Навигация
РАСЧЕТНАЯ ЧАСТЬ
2. РАСЧЕТНАЯ ЧАСТЬ
2.1 МАТЕРИАЛЬНЫЙ БАЛАНС
 | |||
 | |||
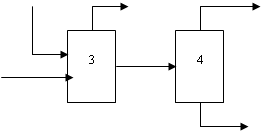
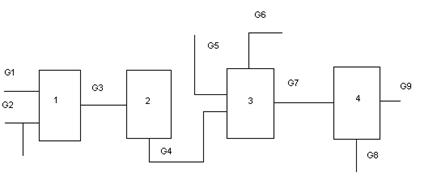
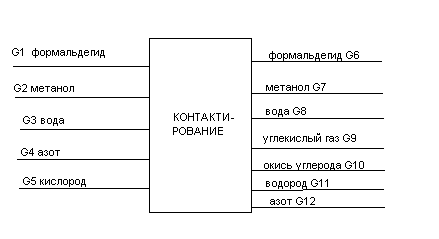
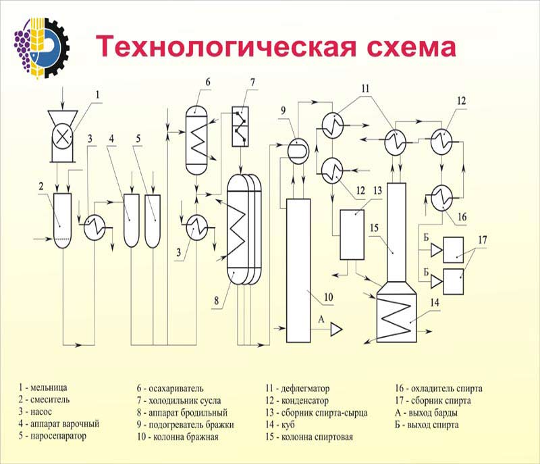
Рис. 2.1 Блок – схема материальных потоков: 1 – приготовление метаноло-воздушной смеси; 2 – контактирование; 3 – абсорбция; 4 – ректификация.
G1 – воздух;
G2 – метанол со склада;
G3 – метанол-ректификат;
G4 – спирто-воздушная смесь;
G5 – контактные газы;
G6 – вода на орошение;
G7 – абсорбционные газы;
G8 – формалин-«сырец»: формальдегид – 28,79%, метанол – 27,24%, вода – 43,97%;
G9 – метанол-ректификат: формальдегид – 97%, метанол – 0,5%, вода – 2,5% ;
G10 – формалин товарный: формальдегид – 37%, метанол – 7%, вода – 56%.
РАСЧЕТ МАТЕРИАЛЬНОГО БАЛАНСА ВСЕГО ПРОЦЕССА
Материальный баланс процесса ректификации
Исходные данные
Годовая производительность одной технологической нитки производства - 126666,6 тонн в год или 15833,33 кг/ч, годовой фонд рабочего времени – 8000 ч. Формалин товарный в расходе – 15833,33 кг/ч.
С учетом заводских данных (массовых долей) рассчитываем количество формальдегида, метанола и воды в формалине товарном в приходе:
15833,33*0,37=5858,33 кг/ч (формальдегид);
15833,33*0,07=1108,33 кг/ч (метанол);
15833,33*0,56=8866,66 кг/ч (вода).
Рассчитываем количество формальдегида, метанола и воды в формалине-«сырце» в приходе, зная заводские данные:Производительность формальдегида в формалине-«сырце» - 5571,75 кг/ч;
Производительность формальдегида в формалине товарном - 5550,00 кг/ч;
5571,75 – 100%
5550,00 - x
x=99,6% (заводская масс. доля формальдегида).
Аналогично рассчитываем для метанола и воды:
5272,50 – 100%
1050,00 – x
x=19,92% (метанол);
8508,90 – 100%
8400,00 – x
x=98,72% (вода).
5858,33 – 99,6%
x – 100%
x=5881,86 кг/ч (производительность формальдегида в формалине-«сырце»);
1108,33 – 19,92%
x – 100%
x=5563,92 кг/ч (производительность метанола в формалине-«сырце»);
8866,66 – 98,72%
x – 100%
x=8981,63 кг/ч (производительность воды в формалине-«сырце»).
Формалин-«сырец» (5881,86 + 5563,92 + 8981,63) = 20427,41 кг/ч.
Производительность формальдегида в метаноле ректификате:
5881,86 - 5858,33 = 23,53 кг/ч.
Производительность метанола в метаноле ректификате:
5563,92 - 1108,33 = 4455,59 кг/ч.
Производительность воды в метаноле ректификате:
8981,63 - 8866,66 = 114,96 кг/ч.
Метанол ректификат (23,53 + 4455,59 + 114,96) = 4594,08 кг/ч.
Материальный баланс стадии ректификации в таблице 9.
Таблица 9 – Материальный баланс стадии ректификации
| Приход | Расход | ||||
| Состав | кг/ч | Массовая доля, % | Состав | кг/ч | Массовая доля,% |
| 1 | 2 | 3 | 4 | 5 | 6 |
| [G8] 1. Формалин- «сырец» в т.ч.: -формальдегид -метанол -вода | 20427,41 5881,86 5563,92 8981,63 | 100 28,79 27,24 43,97 | [G10] 1. Формалин – товарный в т.ч.: -формальдегид -метанол -вода [G9] 2. Метанол – ректификат в т.ч.: -метанол -формальдегид -вода | 15833,33 5858,33 1108,33 8866,66 4594,08 4455,59 23,53 114,96 | 100 37 7 56 100 97 0,5 2,5 |
| Итого: | 20427,41 | 100 | Итого: | 20427,41 | 100 |
Обозначим массовый расход формалина – «сырца» - G8, массовый расход товарного формалина – G10, массовый расход метанола – ректификата - G9.
Материальный баланс:
GF = Gp + Gw (2.1)
GF = G8; Gp = G9; Gw = G10 (2.2)
G8xF = G9xp + G10xw (2.3)
где, GF, Gp, Gw – массовые расходы: питания, дистиллята и кубового остатка, соответственно.
xF, xp, xw – содержание формальдегида в питании, дистилляте и кубовом остатке соответственно, %.
Решим систему уравнений
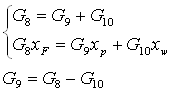 (2.4)
(2.4)
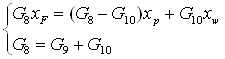

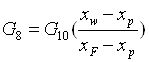
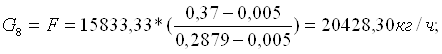
![]()
![]()
G9=P=4594,97=1,28 кг/с;
G10=W=15833,33 кг/ч=4,39 кг/с.
Товарный формалин: содержание воды - 56% , формальдегида 37% и метанола 7%.
Для дальнейших расчетов необходимо концентрации исходной смеси, дистиллята и кубового остатка выразить в мольных долях по формуле:
![]() (2.6)
(2.6)
где, ![]() a,
a, ![]() - концентрации исходной смеси, дистиллята и кубового остатка в массовых долях (a – низкокипящего компонента, b – высококипящего компонента); Ма, Мb – молярные массы низкокипящего и высококипящего компонентов (Мметанол = 32 кг/моль, Мформ-да = 30 кг/моль).
- концентрации исходной смеси, дистиллята и кубового остатка в массовых долях (a – низкокипящего компонента, b – высококипящего компонента); Ма, Мb – молярные массы низкокипящего и высококипящего компонентов (Мметанол = 32 кг/моль, Мформ-да = 30 кг/моль).
Метанол - низкокипящий компонент (температура кипения 64,5°С);
Формальдегид - высококипящий компонент (температура кипения 98,9°С).
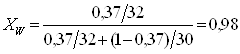 ,
,
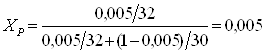 ,
,
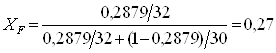 .
.
Материальный баланс процесса абсорбции
Из заводских данных:
Количество формалина-«сырца» - 19353,15 кг/ч;
Итого процесса абсорбции – 29515,65 кг/ч;
29515,65 – 100%
19353,15 – x
x=65,59% (формалин-«сырец»)
Тогда всего в процессе абсорбции будет:
20427,41 – 65,59%
x – 100%
x=31144,09 кг/ч.
Количество выхлопных газов в расходе (31144,09-20427,41)=10716,68 кг/ч.
Тогда рассчитываем количество азота, водорода, углекислого газа, окиси углерода и воды в выхлопных газах:
10716,68 – 100%
x – 77,27%
x=8280,78 кг/ч (азот);
10716,68 – 100%
x – 16,62%
x=1781,11 кг/ч (водород);
10716,68 – 100%
x – 4,14%
x=443,67 кг/ч (углекислый газ);
10716,68 – 100%
x – 0,68%
x=72,87 кг/ч (окись углерода);
10716,68 – 100%
x – 1,29%
x=138,25 кг/ч (вода).
Производительность формалина-«сырца» берется из процесса ректификации.
Вода на орошение
Из заводских данных:
Количество воды в выхлопных газах – 97,50 кг/ч;
Количество воды в формалине-«сырце» - 8508,90 кг/ч;
Вода на орошение заводская в приходе – 5548,35 кг/ч;
97,50+8508,90=8606,4 кг/ч;
8606,4 – 100%
5548,35 – x
x=64,47% .
Количество воды на орошение в расходе:
138,25+8981,63=9119,88 кг/ч;
9119,88 – 100%
x – 64,47%
x=5879,58 кг/ч;
Контактные газы: (31144,09-5879,58)=25264,51 кг/ч.
Количество формальдегида, метанола, углекислого газа, окиси углерода, водорода и азота в контактном газе рассчитывается:
25264,51 – 100%
x – 23,24%
x=5880,86 кг/ч (формальдегид);
25264,51 – 100%
x – 22%
x=5560,91 кг/ч (метанол);
25264,51 – 100%
x – 12,76%
x = 3223,75 кг/ч (вода);
25264,51 – 100%
x – 3,19%
x=805,94 кг/ч (углекислый газ);
25264,51 – 100%
x – 0,58%
x=146,53 кг/ч (водород);
25264,51 – 100%
x – 0,33%
x=83,37 кг/ч (окись углерода);
25264,51 – 100%
x – 37,9%
x=9575,25 кг/ч (азот).
Материальный баланс абсорбционной колонны в таблице 10.
Таблица 10 – Материальный баланс абсорбционной колонны
| Приход | Расход | ||||
| Состав | кг/ч | Массовая доля, % | Состав | кг/ч | Массовая доля, % |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 1. Контактные газы, в т.ч.: -формальдегид метанол -вода -углекислый газ -водород -окись углерода -азот 2. Вода на орошение | 25264,51 5880,86 5560,91 3223,75 805,94 146,53 83,37 9575,25 5879,58 | 100 23,24 22 12,76 3,19 0,58 0,33 37,9 100 | 1. Формалин – «сырец» в т.ч.: -формальдегид -метанол -вода 2. Выхлопные газы, в т.ч.: -азот -водород -углекислый газ -окись углерода -вода | 20427,41 5881,8 5563,92 8981,63 10716,68 8280,78 1781,11 443,67 72,87 138,25 | 100 28,79 27,24 43,97 100 77,27 16,62 4,14 0,68 1,29 |
| Итого: | 31144,09 | 100 | Итого: | 31144,09 | 100 |
Материальный баланс стадии контактирования и приготовления спирто-воздушной смеси
КонтактированиеКоличество контактных газов в расходе равно количеству контактных газов в приходе процесса абсорбции – 25264,51 кг/ч.
Количество контактных газов равно количеству смеси воздух-метанол - 25264,51 кг/ч.
Рассчитываем количество формальдегида, метанола, воды, азота и кислорода в приходе:
25264,51 – 100%
x – 0,09%
x=22,74 кг/ч (формальдегид);
25264,51 – 100%
x – 46,5%
x=11748,00 кг/ч (метанол);
25264,51 – 100%
x – 1,76%
x=444,66 кг/ч (вода);
25264,51 – 100%
x – 40,76%
x= 10297,81 кг/ч (азот);
25264,51 – 100%
x – 10,89%
x=2751,31 кг/ч (кислород).
Спиртоиспарение
Количество смеси воздух-метанол в расходе равно количеству смеси воздух-метанол в приходе процесса контактирования – 25264,51 кг/ч.
Из заводских данных:
Итого процесса спиртоиспарения – 23967,30 кг/ч;
Количество воздуха в приходе – 11988,00 кг/ч;
Количество метанола-ректификата в приходе – 4353,15 кг/ч;
Количество метанола «свежего» в приходе – 7626,15 кг/ч;
23967,30 – 100%
11988,00 – x
x=50,02% (воздух);
23967,30 – 100%
4353,15 – x
x=18,16% (метанол-ректификат);
23967,30 – 100%
7626,15 – x
x=31,82% (метанол «свежий»).
Рассчитываем количество метанола «свежего» в приходе и входящего в него метанола и воды:
25264,51 – 100%
x – 31,82%
x=8039,17 кг/ч (метанол «свежий»);
8039,17 – 100%
x – 99,9%
x=8031,13 кг/ч (метанол);
8039,17 – 100%
x – 0,1%
x=8,04 кг/ч.
Рассчитываем количество метанола-ректификата в приходе и входящего метанола, формальдегида и вода:
25264,51 – 100%
x – 18,16%
x=4588,04 кг/ч (метанол-ректификат);
4588,04 – 100%
x – 97%
x=4450,39 кг/ч (метанол);
4588,04 – 100%
x – 0,5%
x=22,94 кг/ч (формальдегид);
4588,04 – 100%
x – 2,5%
x=114,70 кг/ч (вода).
Рассчитываем количество воздуха в приходе и входящего в него кислорода, азота и воды:
25264,51 – 100%
x – 50,02%
x=12637,31 кг/ч (воздух);
12637,31 – 100%
x – 20,7%
x=2615,92 кг/ч (кислород);
12637,31 – 100%
x – 77,5%
x=9793,91 кг/ч (азот)
12637,31 – 100%
x – 1,8%
x=227,47 кг/ч (вода).
Материальный баланс стадии контактирования и приготовления спирто – воздушной смеси в таблице 11.
Таблица 11 – Материальный баланс стадии контактирования и приготовления сприрто – воздушной смеси
| Приход | Расход | ||||
| Состав | кг/ч | Массовая доля, % | Состав | кг/ч | Массовая доля, % |
| Контактирование | |||||
| 1. Смесь воздух – метанол, в т.ч.: формальдегид -метанол -вода -азот -кислород | 25264,51 22,74 11748,00 444,66 10297,81 2751,31 | 100 0,09 46,5 1,76 40,76 10,89 | 1 Контактные газы, в т.ч.: формальдегид -метанол -вода -углекислый газ -окись углерода -водород -азот | 25264,51 5880,86 5560,91 3223,75 805,94 146,53 83,37 9575,25 | 100 23,24 22 12,76 3,19 0,33 0,58 37,9 |
| Итого: | 25264,51 | 100 | Итого: | 25264,51 | 100 |
| Приход | Расход | ||||
| Состав | кг/ч | Массовая доля, % | Состав | кг/ч | Массовая доля, % |
| Спиртоиспарение | |||||
| Метанол «свежий» в т.ч.: -метанол -вода 2. Метанол – ректификат, в т.ч.: -метанол -формальдегид -вода 3. Воздух, в т.ч.: -кислород -азот -вода | 8039,17 8031,13 8,04 4588,03 4450,39 22,94 114,70 12637,31 2615,92 9793,91 227,47 | 100 99,9 0,1 100 97 0,5 2,5 100 20,7 77,5 1,8 | Смесь воздух – метанол, в т.ч.: -формальдегид -метанол -вода -азот -кислород | 25264,51 22,74 11748,00 444,66 10297,81 2751,31 | 100 0,09 46,5 1,76 40,76 10,89 |
| Итого: | 25264,51 | 100 | Итого: | 25264,51 | 100 |
Построение диаграмм
Для идеальных смесей диаграммы можно построить путем расчета, исходя из значений давлений паров чистых компонентов РН.К и РВ.К при различных температурах. Для этого можно воспользоваться уравнением:
![]()
![]() (2.7)
(2.7)
Решив от относительно x, получим:
![]()
(2.8)
Таким образом, выбрав ряд температур (в пределах между температурами кипения чистых компонентов), можно вычислить состав жидкости, кипящей при данной температуре. Далее, определив парциальное давление НК по формуле:
![]()
(2.9)
находим состав паров:
![]() (2.10)
(2.10)
где, Робщ = 427 мм рт. ст. Давление общее соответствует давлению верха колонны.
Давление верха равно 0,057 Мпа;
Переводим в мм рт. ст.: 0,057*106Па*760 мм рт. ст. /101325 Па = 427,5 мм рт. ст.
Данные расчета сводятся в табл.12 (расчет равновесного состава жидкости и пара смеси метанол – формальдегид).
Рассчитываем давление (Рн.к) для метанола.
Данные значений давлений низкокипящего компонента (метанол) при различных температурах берем из [1, стр.26 ].
Из данных [1, стр.26 ] рассчитываем давление при известных температурах.
Интервал температур от 64,7 до 98,9°С.
При температуре 60°С давление составляет 625 мм рт. ст., а при температуре 70°С давление равно 927 мм рт. ст.
1) Находим давление при температуре 64,7°С:
(927 – 625)/10 = 30,2 на 1°С;
(64,7 – 60)*30,2 = 142,4;
625 + 142,4 = 767,4 мм рт. ст..
2) Находим давление при температуре 68,12°С:
(68,12 – 60)*30,2 = 246,1;
625 + 246,1 = 871,1 мм рт. ст..
При температуре 70°С давление составляет 927 мм рт. ст., а при температуре 80°С давление равно 1341 мм рт. ст.
3) Находим давление при температуре 71,54°С:
(1341 – 927)/10 = 41,4 на 1°С;
(71,54 – 70)*41,4 = 64,2;
927 + 64,2 = 991,2 мм рт. ст..
4) Находим давление при температуре 74,96°С:
(74,96 – 70)*41,4 = 206,7;
927 + 206,7 = 1133,7 мм рт. ст..
5) Находим давление при температуре 78,38°С:
(78,38 – 70)*41,4 = 349,2;
927 + 349,2 = 1276,2 мм рт. ст..
При температуре 80°С давление составляет 1341 мм рт. ст., а при температуре 90°С давление равно 1897 мм рт. ст.
6) Находим давление при температуре 81,8°С:
(1847 – 1341)/10 = 55,6 на 1°С;
(81,8 – 80)*55,6 = 100;
1341 + 100 = 1441 мм рт. ст..
7) Находим давление при температуре 85,22°С:
(85,22 – 80)*55,6 = 290;
1341 + 290 = 1631 мм рт. ст..
8) Находим давление при температуре 88,64°С:
(88,64 – 80)*55,6 = 480;
1341 + 480 = 1821 мм рт. ст..
При температуре 90°С давление составляет 1897 мм рт. ст., а при температуре 100°С давление равно 2621 мм рт. ст.
9) Находим давление при температуре 92,06°С:
(2621 – 1897)/10 = 72,4 на 1°С;
(92,06 – 90)*72,4 = 147,1;
1897 + 147,1 = 2044,1 мм рт. ст..
10) Находим давление при температуре 95,48°С:
(95,48 – 90)*72,4 = 391,4;
1897 + 391,4 = 2288,4 мм рт. ст..
11) Находим давление при температуре 98,9°С:
(98,9 – 90)*72,4 = 635,7;
1897 + 635,7 = 2532,7 мм рт. ст..
Данные расчета сводятся в табл.12 (расчет равновесного состава жидкости и пара смеси метанол – формальдегид).
Рассчитываем давление (Рв.к) дла формальдегида.
Из экспериментальных данных о фазовом равновесии системы находятся константы А, В и С в уравнении Антуана, описывающего температурную зависимость давления паров некоторого гипотетического состояния формальдегида в чистом виде, но с учетом взаимодействия с водой [1, стр 35 ]. Полученное выражение имеет вид:
![]() (2.11)
(2.11)
![]() (2.12)
(2.12)
1) Находим давление при температуре 64,7°С:
![]()
P = 70,3 мм рт. ст..
2) Находим давление при температуре 68,12°С:
![]()
P = 83,8 мм рт. ст..
3) Находим давление при температуре 71,54°С:
![]()
P =99,3 мм рт. ст..
4) Находим давление при температуре 74,96°С:
![]()
P = 117,2 мм рт. ст..
5) Находим давление при температуре 78,38°С:
![]()
P = 138 мм рт. ст..
6) Находим давление при температуре 81,8°С:
![]()
P = 161,4 мм рт. ст..
7) Находим давление при температуре 85,22°С:
![]()
P = 188,8 мм рт. ст..
8) Находим давление при температуре 88,64°С:
![]()
P = 219,3 мм рт. ст..
9) Находим давление при температуре 92,06°С:
![]()
P = 254,7 мм рт. ст..
10) Находим давление при температуре 95,48°С:
![]()
P = 293,8 мм рт. ст..
11) Находим давление при температуре 98,9°С:
![]()
P = 338,8 мм рт. ст..
Данные расчета сводятся в табл.12 (расчет равновесного состава жидкости и пара смеси метанол – формальдегид)
Далее рассчитываем состав жидкости по формуле (2.8):

Данные расчета сводятся в табл.12 (расчет равновесного состава жидкости и пара смеси метанол – формальдегид).
Находим состав паров по формуле (2.10):

Данные расчета сводятся в табл.12 (расчет равновесного состава жидкости и пара смеси метанол – формальдегид).
Таблица 12 – Расчет равновесного состава жидкости и пара смеси метанол – формальдегид
| t,°C | Рн.к | Рв.к | X | Y |
| мм рт. ст. | мольные доли | |||
| 64,7 | 767,4 | 70,3 | 0,51 | 0,92 |
| 68,12 | 871,1 | 83,8 | 0,44 | 0,89 |
| 71,54 | 991,2 | 99,3 | 0,37 | 0,86 |
| 74,96 | 1133,7 | 117,2 | 0,31 | 0,82 |
| 78,38 | 1276,1 | 138 | 0,25 | 0,75 |
| 81,8 | 1441 | 161,4 | 0,21 | 0,71 |
| 85,22 | 1631 | 188,8 | 0,17 | 0,65 |
| 88,64 | 1821 | 219,3 | 0,13 | 0,55 |
| 92,06 | 2044,1 | 254,7 | 0,10 | 0,48 |
| 95,48 | 2288,4 | 293,8 | 0,06 | 0,32 |
| 98,9 | 2532,7 | 338,8 | 0,04 | 0,24 |
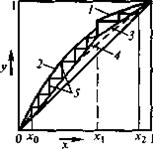
Построение кривой равновесия пара и жидкости на диаграмме X – Y показано на рис.2.2. На осях откладывается максимальная концентрация низкокипящего компонента (в данном случае метанола) в паровой yм и жидкой xм фазах (100%), строится квадрат. Через полученную точку А и начало координат О проводим вспомогательную линию – диагональ ОА. Кривую равновесия строим в заданном масштабе по xм и yм при различных температурах (см. табл. 12). На пересечении перпендикуляров, восстановленных из точек x1, y1; x2, y2; x3, y3; … …, получаем точки А1, А2, А3, … Соединяя эти точки плавной линией, получаем кривую равновесия. Если линия равновесия лежит выше диагонали, то пары обогащаются низкокипящим компонентом. Чем ближе линия равновесия к диагонали, тем меньше разница составов пара и жидкости и тем труднее разделяется смесь при ректификации.
График изменения составов жидкости и пара от температуры t – X – Y строится следующим образом (рис.2.3). В соответствии с табл. 12 отложим на оси ординат температуры кипения чистых компонентов tA и tB (А – метанол, В – формальдегид) и температуры кипения t1, t2, t3, …, соответствующие составам жидкой фазы x1, x2, x3, … Восстановим из этих точек перпендикуляры и, соединив точки А1, А2, А3, … плавной линией, получим кривую ВА1А2А3 … А – линию кипения жидкости. Затем на оси абсцисс откладываем составы паровой фазы y1, y2, y3, …, равновесной с данной кипящей жидкостью, и проводим перпендикуляры до пересечения с линиями, проведенными через t1, t2, t3, … Соединив точки пересечения В1, В2, В3, …, В плавной линией, получим кривую ВВ1В2В3 … А – линию конденсации. С помощью этого графика можно определить температуру жидкости и пара любого состава и наоборот, найти составы жидкости и пара при заданной температуре. Для определения температуры кипения исходной смеси проводим вертикаль из точки xF, соответствующей концентрации исходной смеси по низкокипящему компоненту, до пересечения с линией кипения жидкости в точке А¢. Из точки А¢ опускаем перпендикуляр на ось y и находим значение температуры кипения tF.
Таким образом tF = 76,9°С. Аналогично для дистиллята и кубового остатка: tP = 64,8°C, tW = 98,4°C.
Состав пара yF = 0,788, yP = 0,998, yW = 0,164.
Определение рабочего флегмового числаРабочее флегмовое число рассчитывается по формуле:
![]() (2.13)
(2.13)
Минимальному флегмовому числу Rmin соответствует положение линий рабочих концентраций АВ и ВС (рис.2.2):
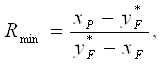 (2.14)
(2.14)
где, y*, x* - координаты точек пересечения линий питания с линией равновесия (yF* = 0,778, xF* = 0,27);
xp и xf – массовый состав дистиллята и исходной смеси.
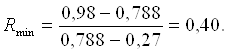
На рис.2.2 проводим прямую СЕ через точку В пересечения вертикали с линией равновесия и через точку С на диагонали, соответствующую составу дистиллята xp. Измерив отрезок b0, отсекаемый прямой СЕ на оси ординат, находят Rmin из формулы:
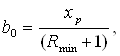 (2.15)
(2.15)
где, xp – мольный состав дистиллята;
откуда ![]()
b0 = 0,70,
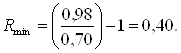
Задавшись различными коэффициентами избытка флегмы b, определим соответствующие флегмовые числа R [2, стр. 46 ]. По формуле (2.15) рассчитываем величину b; графическим построением ступеней изменения концентраций между равновесной и рабочими линиями на диаграмме Y – X находим N и далее N(R+1). Построение рабочих линий и ступеней изменения концентраций выполняется для каждого заданного коэффициента избытка флегмы и рассчитанного флегмового числа.
Вычисляем R, b, N, N(R+1) при различных значениях b:
флегмовое число вычисляем по формуле (2.13), а b0 по (2.15):
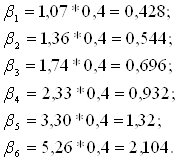
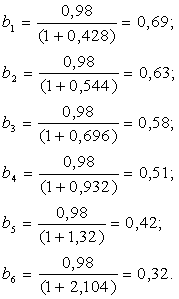
Чтобы определить количество тарелок, надо графически изобразить линии рабочего процесса в колонне. Колонну непрерывного действия от места ввода исходной смеси делят на две части: верхняя часть колонны называется укрепляющей, а нижняя часть – исчерпывающей. Для укрепляющей части колонны уравнение линии рабочих концентраций определяется соотношением (2.16):
![]() ,
,
в котором выражение R/(R+1) есть тангенс угла наклона линии, а отрезок, отсекаемый линией на оси y, определяется зависимостью b = xp/(R+1). Для построения линий рабочих концентраций укрепляющей и исчерпывающей части колонны откладываем на оси абсцисс точки А, В, С (рис 2.3), соответствующие составам кубового остатка xw, исходной смеси xf и дистиллята xp, проводим через точки А и С вертикали до пересечения с диагональю и получаем точки А1 и С1. Откладываем на оси ординат отрезок ОЕ, длина которого определяется соотношением b = xp/(R+1). Через точки С1 и Е проводим прямую С1Е, а через точку В – вертикаль до пересечения с линией С1Е и получаем точку В1. Соединяем точки А1 и В1 линией А1В1. Отрезок С1В1 – линия рабочих концентраций укрепляющей части колонны, отрезок А1В1 – линия концентраций исчерпывающей части колонны. Число теоретических тарелок находим путем построений ступенчатой линии между линией равновесия и линиями рабочих концентраций в пределах от xw до xp. Эту процедуру делаем 6 раз т. к. дано 6 значений b т.е. отрезков ОЕ.
Количество ступеней (тарелок), полученные из рис.2.3 равно: 13, 9, 8, 7, 8, 5.
Полученные значения заносим в таблицу 13.
Таблица 13
| b | 1,07 | 1,36 | 1,74 | 2,33 | 3,30 | 5,26 |
| R | 0,428 | 0,544 | 0,696 | 0,932 | 1,32 | 2,104 |
| b | 0,69 | 0,63 | 0,58 | 0,51 | 0,42 | 0,32 |
| N | 13 | 9 | 8 | 7 | 8 | 5 |
| N(R+1) | 18,564 | 13,896 | 13,568 | 13,524 | 18,56 | 15,52 |
Результаты вычислений и построений представлены на рис.2.4
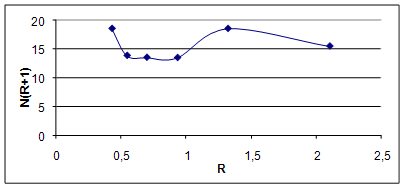
Рис. 2.4 Определение оптимального рабочего флегмового числа
Минимальное произведение N(R+1) соответствует оптимальному рабочему флегмовому числу, Ropt = 0,932.
Определение действительного числа тарелокДействительное число тарелок в ректификационных колоннах всегда больше теоретического числа, поскольку в реальных условиях равновесие фаз в результате контактного тепломассообмена на тарелках не достигается. Другими словами, коэффициент полезного действия тарелки всегда меньше единицы. Известно несколько методов расчета действительного числа тарелок. В данном случае мы используем графоаналитический метод, как наиболее простой и менее трудоемкий, хотя и несколько менее точный. В соответствии с этим методом действительное число тарелок определяется по уравнению:
![]() (2.17)
(2.17)
здесь h - усредненный коэффициент полезного действия тарелки для всей колонны в целом [4, стр. 65];
N – теоретическое число тарелок.
По литературным данным к. п. д. тарелки изменяется в пределах h = 0,2 ¸ 0,9. При выборе значения к. п. д. тарелки можно пользоваться обобщенным графиком [4, стр. 32] зависимости к. п. д. от произведения относительной летучести a на динамический коэффициент вязкости m (в мПа*с) перегоняемой смеси.
Относительную летучесть определяют по формуле:
 (2.18)
(2.18)
где, y* и x* - соответственно равновесные составы паровой и жидкой фаз на соответствующих тарелках (y*нк = 0,712, x*нк = 0,212).
y* и x* определяем из рис. 2 при средней температуре верха и низа колонны: ![]() .
.
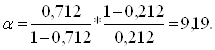
Динамический коэффициент вязкости смеси определяется по формуле:
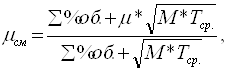 (2.19)
(2.19)
где, m - динамическая вязкость веществ (метанола, формальдегида и воды) при tср, Па*с;
М – молекулярные массы веществ (метанола, формальдегида и воды);
Тср – средняя температура в К (81,6 + 273 = 354,6°С).
Рассчитываем вязкость воды и метанола при tср.= 81,6°С:
Данные взяты из справочника [5, стр. 61 ].
При температуре 80°С вязкость равна 0,657 Па*с, а при температуре 100°С вязкость равна 0,234 Па*с, определяем вязкость при 81,6°С:
(0,657 - 0,234)/20*1,6 = 0,00003384 Па*с;
0,657 – 0,00003384 = 0,66 Па*с (вода).
При температуре 80°С вязкость равна 0,29 Па*с, а при температуре 100°С вязкость равна 0,24 Па*с, определяем вязкость при 81,6°С:
(0,29 – 0,24)/20*1,6 = 0,0000064 Па*с;
0,29 – 0,0000064 = 0,29 Па*с (метанол).
Вязкость формальдегида принимаем 0,91 кг*с/м2 из [6, стр. 78].
Переводим в Па*с:
0,91 кг*с/м2 = 0,000091 кг*с/см2,
Похожие работы
... и красный уголок. Все рассмотренные помещения соединяются между собой с помощью коридоров, лестничных клеток, галерей и тамбуров. 11. БЕЗОПАСНОСТЬ И ЭКОЛОГИЧНОСТЬ ПРОЕКТА ПРОИЗВОДСТВА ФОРМАЛИНА Химическое производство относится к отрасли промышленности, которая представляет потенциальную опасность профессиональных заболеваний и отравлений работающих. Число отравлений и профессиональных ...
... и другом случае одинаков и может быть представлен следующей схемой: гексозы—фосфорные эфиры—гексоз-фосфотриозы—фосфоглицериновая кислота—пировиноградная кислота—уксусный альдегид—этиловый спирт. В основе производства этилового спирта из клубней картофеля лежат два биохимических процесса: ü гидролиз (осахаривание) крахмала, содержащегося в сырье, и сбраживание образующихся сахаров в спирт ...
... смеси на четыре продукта [17]. I – IV — продукты. 2. ПОСТАНОВКА ЗАДАЧИ ИССЛЕДОВАНИЯ. Целью настоящей работы является определение оптимальных рабочих параметров процесса экстрактивной ректификации смеси ацетон-хлороформ азеотропного состава в сложной колонне с боковой укрепляющей секцией. К таким параметрам относятся температура и расход разделяющего агента, тарелки подачи исходной смеси и ...
... , а также при дроблении горячих слитков, разгрузке и ремонте доменных печей и т.п. 2. Методическая разработка факультативных занятий по химии На основе дипломной работы были разработаны факультативные занятия в виде лекций по теме Бризантные взрывчатые вещества для учащихся старших классов средней общеобразовательной школы. Задачи факультативных занятий: 1. Повысить познавательный ...

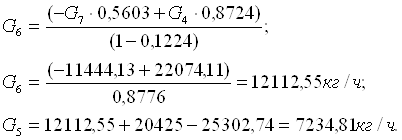


0 комментариев