Навигация
Виды коррозионных разрушений
1.3 Виды коррозионных разрушений
Коррозия, в зависимости от природы металла, агрессивной среды и других условий, приводит к различным видам разрушений. На рис. 1 представлены разрезы через прокорродировавший образец металла, показывающие возможные изменения рельефа поверхности в результате коррозии.
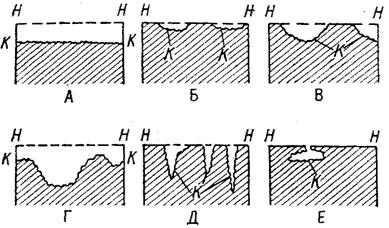
Рисунок 1.1 – Схематическое изображение различных видов коррозии:
А – равномерная коррозия; Б – коррозия пятнами; В, Г – коррозия язвами; Д – точечная коррозия (питтинг); Е – подповерхностная коррозия; НН – исходная поверхность металла; КК – рельеф поверхности, измененный вследствие коррозии.
Иногда коррозия протекает со скоростью, почти одинаковой по всей поверхности; в таком случае поверхность становится только немного более шероховатой, чем исходная (рисунок 1.1А) Часто наблюдается различная скорость коррозии на отдельных участках: пятнами (рисунок 1.1Б), язвами (рисунок 1.1В и 1.1Г). Если язвы имеют малое сечение, но относительно большую глубину, (рисунок 1.1Д), то говорят о точечной коррозии (питтинг). В некоторых условиях небольшая язва распространяется вглубь и вширь под поверхностью (рисунок 1.1E).
Неравномерная коррозия значительно более опасна, чем равномерная. Неравномерная коррозия, при сравнительно небольшом количестве окисленного металла, вызывает большое уменьшение сечения в отдельных местах. Язвенная или точечная коррозия могут привести к образованию сквозных отверстий, например в листовом материале, при малой потере металла [31].
Приведенная классификация, конечно, условна. Возможны многочисленные формы разрушения, лежащие между характерными типами, показанными на рисунок 1.2.
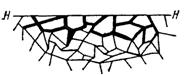
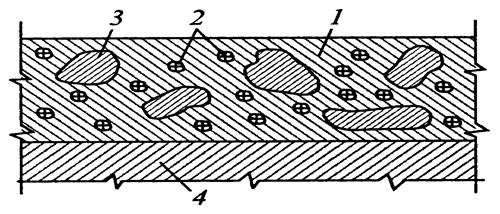
Рисунок 1.2 – Межкристаллитная коррозия.
Некоторые сплавы подвержены своеобразному виду коррозии, протекающей только по границам кристаллитов, которые оказываются отделенными друг от друга тонким слоем продуктов коррозии (межкристаллитная коррозия). Здесь потери металла очень малы, но сплав теряет прочность. Это очень опасный вид коррозии, который нельзя обнаружить при наружном осмотре изделия.
1.4 Термодинамическая оценка процесса электрохимической коррозии
Процесс электрохимической коррозии совокупность двух сопряженно протекающих реакций:
![]() (анодный процесс),
(анодный процесс),
![]() (катодный процесс),
(катодный процесс),
где D – деполяризатор (окислитель).
Причина коррозии – термодинамическая неустойчивость металлов, сплавов и сталей в агрессивной среде. Определить вероятность протекания коррозионного процесса, как и любого электрохимического процесса, можно по изменению энергии Гиббса:
![]() (1.3)
(1.3)
Известно, что любая реакция протекает в данном направлении, если при этом уменьшается энергия Гиббса ΔG <0. Энергия Гиббса ΔG связана с ЭДС электрохимической реакции следующим соотношением.
![]() , (1.4)
, (1.4)
где ![]() .
.
Таким образом, ![]()
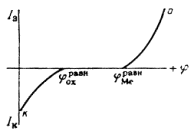
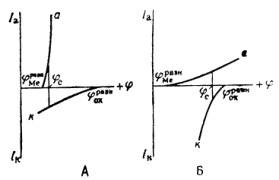
Из последнего уравнения видно, что коррозия металла протекает самопроизвольно при условии, что равновесный потенциал окислителя ![]() более положителен, чем равновесный потенциал металла
более положителен, чем равновесный потенциал металла ![]() [28, 31].
[28, 31].
1.5 Кинетическое обоснование процесса коррозии
В настоящее время считается достаточно строго обоснованной кинетическая теория. Она пришла на смену устаревшей теории микрогальванических (локальных) элементов.
Коррозионные процессы являются гетерогенными химическими реакциями и к ним применили почти все положения формальной кинетики. Так, рассматривая этот процесс в виде последовательных стадий: 1) доставка вещества к поверхности; 2) адсорбция; 3) собственно реакция; 4) образование (или исчезновение) новой фазы; 5) отвод продуктов.
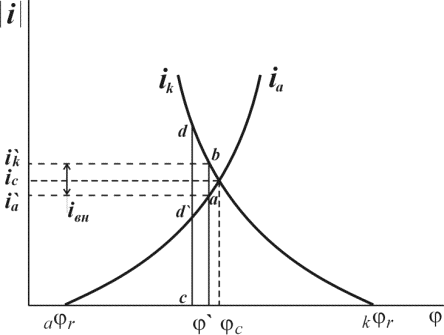
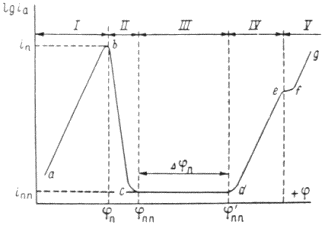
Любая из этих пяти стадий электрохимического процесса может протекать затрудненно по сравнению с остальными. Поскольку в стационарных условиях скорость всего процесса определяется самой медленной стадией, то для того, чтобы эту стадию ускорить требуется определенные энергетические затраты, вызывающие перенапряжение [5, 6].
Если замедлена доставка ионов к поверхности или отвод продуктов реакция (транспортная стадия), а все остальные стадии (разряд ионов, ионизация металла, образование или разрушение кристаллической решетки) протекают без затруднений, быстро, то возникает концентрационное перенапряжение.
Если замедлена только собственно электрохимическая реакция, то есть разряд ионов или окисление металла с отдачей электронов (эту стадия часто называют переносом заряда), то возникает химическое или активационное перенапряжение.
Если эта стадия не требует ускорения, но затруднена стадия образования новой фазы, возникает фазовое перенапряжение [6].
Похожие работы
... составов, застойные воды и некоторые органические продукты. Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в ...
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...


0 комментариев