Навигация
Рассчитаем расходную часть теплового баланса
3.2 Рассчитаем расходную часть теплового баланса
Определим количество тепла, которое выходит из реактора с продуктами реакции:
![]() ;
;
![]() ;
;
где Срj – изобарные теплоемкости исходных реагентов;
Gj – мольный поток j-того реагента;
Тj – температура исходных реагентов.
а) рассчитаем для циклогексанона:
![]()
![]()
![]()
![]()
б) рассчитаем для воды:
![]()
![]()
![]()
![]()
в) рассчитаем для циклогексанола:
![]()
![]()
![]()
![]()
г) рассчитаем для непрореагировавшего циклогексана:
![]()
![]()
![]()
![]()
д) рассчитаем для непрореагировавшего кислорода:
![]()
![]()
![]()
![]()
е) рассчитаем для бензола:
![]()
![]()
![]()
![]()
ж) рассчитаем для азота:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Определим количество тепла, расходуемое на нагревание исходных реагентов до температуры химической реакции:
![]() ;
;
![]()
![]()
![]()
а) рассчитаем для циклогексана:
![]()
![]()
![]()
![]()
б) рассчитаем для кислорода:
![]()
![]()
![]()
![]()
в) рассчитаем для бензола:
![]()
![]()
![]()
![]()
г) рассчитаем для азота:
![]()
![]()
![]()
![]()
![]()
![]()
![]() .
.
Определим тепловые потери в ходе реакции:
![]()
![]()
![]()
![]()
![]() .
.
Определим тепловую нагрузку на реактор:
![]()
![]()
![]()
![]()
![]()
![]()
Так как QF > 0, тепло надо нужно подводить, это значение ставиться в приход теплового баланса.
Полученные данные сводим в таблицу теплового баланса:
Таблица 6. Тепловой баланс| Приход | Расход | ||||
| Тепловой поток |
| % | Тепловой поток |
| % |
|
| 70089,98 | 39,40 |
| 133202,082 | 74,88 |
|
| 68567,33 | 22,05 |
| 32208,3592 | 18,10 |
|
| 39232,2891 | 38,55 |
| 12479,1579 | 7,02 |
| Итого: | 177889,5991 | 100 | Итого: | 177889,5991 | 100 |
Определим поверхность теплообмена:
![]()
![]()
![]()
![]()
Вывод: Таким образом, в результате проведенного расчета теплового баланса установили что данная реакция экзотермическая (т.к. ![]() >0) идет с выделением тепла. Для поддержания заданной температуры тепло необходимо подводить в количестве QF=39232,2891
>0) идет с выделением тепла. Для поддержания заданной температуры тепло необходимо подводить в количестве QF=39232,2891 ![]() . Процент подводимого тепла невысокий, значит мы можем предположить что температура для данного процесса выбрана оптимальная.
. Процент подводимого тепла невысокий, значит мы можем предположить что температура для данного процесса выбрана оптимальная.
Проведя расчеты теплового баланса также мы определили количество тепла, расходуемое на нагревание исходных реагентов до температуры реакции ![]()
![]() ; количество тепла на входе в реактор
; количество тепла на входе в реактор ![]()
![]() ; количество тепла на выходе из реактора
; количество тепла на выходе из реактора ![]()
![]() ; тепловые потери
; тепловые потери ![]()
![]() ; поверхность теплообмена
; поверхность теплообмена ![]()
![]() .
.
IV. Термодинамический анализ основной реакции
При проектировании технологических процессов важное место занимают термодинамические расчеты химических реакций.
Цель термодинамического анализа заключается в определении принципиальной возможности проведения химической реакции в данных условиях, в выборе условий проведения процесса.
Задание: Для основной реакции необходимо рассчитать константу равновесия по термодинамическим данным (тепловой эффект реакции, изменение энтропии, свободную энергию Гиббса (изобарно-изотермический потенциал)).
Дано:
![]()
Таблица 7. Термодинамические свойства веществ – участников реакции
| Вещество |
|
|
| Ср = f(Т) | |||
| а | в*103 | c*106 | c’*10-5 | ||||
| С6Н12 | -123,1 | 298,2 | 106,3 | 51,72 | 598,8 | -230,0 | – |
| О2 | 0 | 205,04 | 29,37 | 31,46 | 3,39 | – | -3,77 |
| С6Н10О | -198 | 296 | – | 3,08 | 565 | 300 | – |
| Н2О | -241,81 | 188,72 | 33,61 | 30,00 | 10,71 | – | 0,33 |
Таблица 8. Данные термодинамического расчета
| Т, ºС | 40 | 90 | 140 | 190 | 240 | 290 | 340 | 390 | 440 | 490 | 540 |
| К | 313 | 363 | 413 | 463 | 513 | 563 | 613 | 663 | 713 | 763 | 813 |
Рассчитаем тепловой эффект реакции при атмосферном давлении в заданном температурном интервале.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рассчитаем изменение энтропии при атмосферном давлении в заданном температурном интервале:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рассчитаем изменение изобарно-изотермического потенциала (энергии Гиббса) в заданном температурном интервале:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рассчитаем логарифм константы равновесия в заданном температурном интервале используя уравнение изотермы Вант-Гоффа:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рассчитаем константы равновесия в заданном температурном интервале:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Полученные данные сведем в таблицу:
Таблица 9. Зависимость термодинамических функций от температуры
| Т, К |
|
|
| ln Kp | Кр |
| 313 | -316788,5328 | -18,78 | -310910,3928 | 119,4761 |
|
| 363 | -316578,3304 | -18,18 | -309978,9904 | 102,7107 |
|
| 413 | -315523,5650 | -15,49 | -309126,1950 | 90,0276 |
|
| 463 | -313477,5833 | -10,83 | -308463,2933 | 80,1332 |
|
| 513 | -311452,4869 | -4,34 | -309226,0669 | 72,5018 |
|
| 563 | -305850,4960 | 3,92 | -308057,4560 | 65,8132 |
|
| 613 | -299995,0714 | 13,87 | -308497,3814 | 60,5314 |
|
| 663 | -292597,8560 | 25,45 | -309471,2060 | 56,1431 |
|
| 713 | -283524,4650 | 38,63 | -311067,6550 | 52,4753 |
|
| 763 | -272641,0077 | 53,37 | -313362,3177 | 49,3983 |
|
| 813 | -259813,9353 | 69,64 | -316431,2553 | 46,8143 |
|
4.7. На основании полученных данных построим графики:
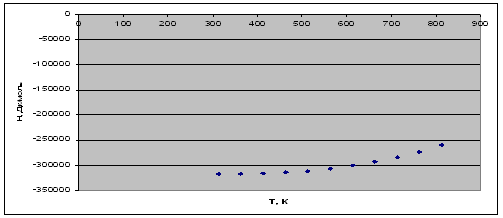
Рис. 1. Зависимость теплового эффекта реакции от температуры.
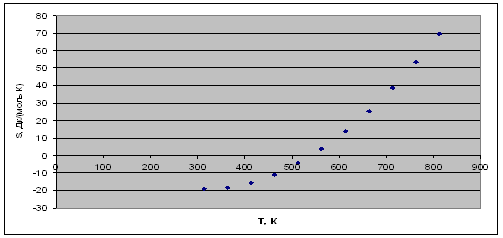
Рис. 2. Зависимость энтропии реакции от температуры.
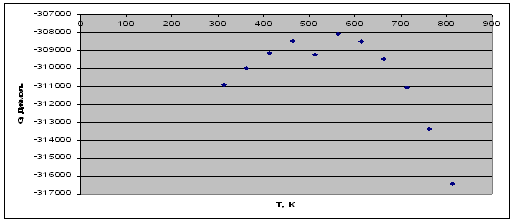
Рис. 3. Зависимость энергии Гиббса от температуры.
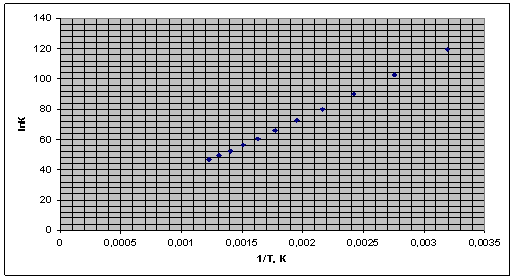
Рис. 4. Зависимость логарифма константы равновесия от обратной температуры.
![]()
![]()
![]()
![]()
613 – -299995,0714
х– -299304
![]() К
К
Выводы: Рассчитав термодинамические величины, получили:
1) Реакция является экзотермической на всем температурном интервале, т.к. ![]() .
.
2) Для проведения процесса оптимальной считается температура 3390С (612 К).
3) С увеличением температуры изменение энтропии в ходе процесса увеличивается.
4) На всем температурном интервале ![]() , следовательно, реакция идет самопроизвольно.
, следовательно, реакция идет самопроизвольно.
5) Кр>>1, следовательно, реакция смещена в прямом направлении (в сторону образования продуктов), т.к. Кр больше 1020 реакция является необратимой.
V. Расчет константы равновесия и равновесного состава реагирующих веществ
Для количественной оценки интенсивности работы различных аппаратов и для технологического расчета производственных процессов используют константу скорости процесса.
Скорость процесса определяет производительность аппарата.
Константа скорости химической реакции представляет собой сложную величину, которая зависит не только от химических свойств реагирующих веществ, но и от их физических характеристик, конструкции аппарата, гидродинамических условий проведения процесса, диффузии реагирующих веществ и продуктов реакции.
Задание: По основной реакции и вычисленной константе равновесия в заданном температурном интервале рассчитать равновесный состав реакционной массы.
Дано:
![]()
![]()
![]()
![]()
Рассчитаем константы равновесия в заданном температурном интервале используя уравнение изотермы Вант-Гоффа:
![]()
![]()
![]()
![]()
![]()
![]()
Выразим константы уравнения через парциальные давления:
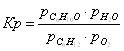
Выразим парциальные давления веществ, участвующих в реакции, через мольные дли вещества:
![]()
![]()
![]()
![]()

Чтобы найти мольные доли веществ составим таблицу молей веществ в состоянии равновесия:
Таблица 10. Мольные доли веществ в состоянии равновесия
|
|
|
|
| |
| Исходная смесь | 0,26 | 0,52 | – | – |
| Образовалось | – | – | х | х |
| Израсходовалось | х | х | – | – |
| Осталось в состоянии равновесия | 0,26-х | 0,52-х | х | х |
![]()
![]()
![]()
![]()
![]()
Полученные значения мольных долей подставляем в уравнение константы равновесия:
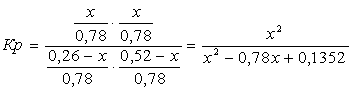
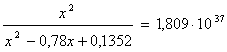
х=0,26
Отсюда находим значение мольных долей:
![]()
![]()
![]()
![]()
Вывод: Таким образом, в ходе проведенных расчетов установили, что в момент равновесия мольная доля вещества составляет ![]() (т.е. циклогексан полностью израсходовался),
(т.е. циклогексан полностью израсходовался), ![]() ,
, ![]() ,
, ![]() . Из этих данных видно, что равновесие смешено в сторону прямой реакции, и практически полностью израсходованы вещества.
. Из этих данных видно, что равновесие смешено в сторону прямой реакции, и практически полностью израсходованы вещества.
VI. Эмпирический расчет теплот сгорания и образования веществ
Задание: Данный пункт рассчитываем для веществ участников основной реакции. Из данных материального баланса выбрать три органических вещества и рассчитать теплоты сгорания по Коновалову и Карашу и определить наиболее точный метод расчета для конкретного вещества. Для этих же веществ рассчитать теплоты образования по энергиям связи. Дано:
Основная реакция![]()
![]()
Похожие работы
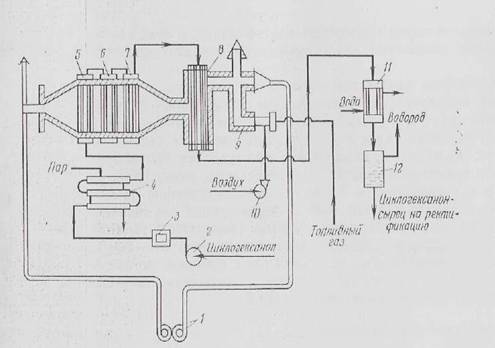
... 80-81 Продукты уплотнения 1 - 1,1 Циклогексанол 17--18 Циклогексен 0,5-0,6Вода 0,2-0,3 Рисунок 1. Технологическая схема процесса получения циклогексанона дегидрированием циклогексанола: 1 - ротационная газодувка; 2 - насос; 3 - фильтр; 4 - подогреватель; 5, 6 - испарители; 7 - перегреватель; 8 - контактный аппарат; 9 - тонка; 10 - воздуходувка; 11 - конденсатор; 12 - сепаратор. ...
... и электротехнической промышленности, в производстве дезинфицирующих средств, в пищевой и химико-фармацевтической промышленности, в получении лаков и эмалей, растворителей, самоотверждающихся составов. 1.3. Синтез адипиновой кислоты В 5-литровую круглодонную колбу, снабженную механической мешалкой, термометром и делительной воронкой емк. В 1л, помещают 2100г (16,6мол) 50%-ной азотной ...
... кристаллы отсасывают, промывают небольшим количеством ледяной воды и сушат при 110оС. Соли можно перекристаллизовывать из воды. NH3 + HReO4 = NH4ReO4 [12] По этой методике был проведен синтез перрената аммония. К 7 мл. концентрированной рениевой кислоты прилили 11 мл. раствора аммиака. В качестве индикатора использовался метилрот ( pH 6.2 - 6.4 ). Белый осадок перрената аммония ...
... из нафты (температура кипения 80 – 160оС) высокооктановых бензинов и ароматических соединений, которые экстрагируют из бензинов и используют в качестве сырья для гидрокрекинга или для органического синтеза. Процесс проводят в интервале 380 – 520оС при давлении 10 – 40 атм на гетерогенных бифункциональных катализаторах – металлических и кислотных – Pt на промотированном Cl– или F– оксиде алюминия ...


0 комментариев