Навигация
Очистка антител к АТФ-зависимому белку с м.м. 55 кДа на колонке с иммобилизованным Белком А
3.9 Очистка антител к АТФ-зависимому белку с м.м. 55 кДа на колонке с иммобилизованным Белком А
Перед очисткой иммуноглобулинов в имеющейся сыворотке измеряли концентрацию белка на спектрофотометре Shimadzu UV-2401 РС (Япония) при длине волны 280 нм. Сыворотку разводили 0.1М Na-фосфатным буфером, pH 7.0 до концентрации белка ~2 мг/мл. Разведенную сыворотку, из расчета 20 мг общего белка, наносили на колонку объемом 1 мл, упакованную конъюгированной с белком A (Amersham, Sigma, USA). После нанесения сыворотки колонку промывали тем же буфером до полного отсутствия белка в элюате. Наличие белка в элюате регистрировали при помощи Uvicord S-II LKB (Швеция).
IgG элюировали с колонки 0.1М Na-цитратным буфером, pH 3.0. Элюат немедленно титровали 1М Трис-HCl, pH 9.0 до pH 7.0. Затем колонку отмывали 0.1 М Na-фосфатным буфером до pH 7.0.
Концентрацию белка в элюате измеряли на спектрофотометре Shimadzu UV-2401 РС (Япония) при длине волны 280 нм. Чистота IgG проверялась при помощи денатурирующего электрофореза в полиакриламидном геле по методу Лэммли [16]. Очищенные IgG разводили глицерином в соотношении 1:1 и хранили при температуре -20ºС.
3.10 Ингибиторный анализ с использованием антител к белку с м.м. 55 кДаАнализ влияния специфических к белку с м.м. 55 кДа антител на параметры функционирования митоКАТФ канала проводили, во-первых, с использованием К+-селективного электрода, определяя скорость ДНФ-индуцированного выхода К+из МХ и концентрацию ионов К+ в матриксе МХ (см. п.п. 3.2.). Во-вторых, с помощью определения энергозависимого входа К+ в МХ методом спектрофотометрии (см. п.п. 3.1.). При проведении ингибиторного анализа в качестве контроля использовалась преимунная сыворотка, а также сыворотка, содержащая специфические антитела на белок с м.м. 55 кДа, подвергнутая предварительно 5-тиминутному кипячению. Также определялось влияние антител на процесс дыхания МХ.
Глава 4. Выделение комплекса цитоплазматических мембран и микросом печени крыс
Для выделения комплекса цитоплазматических мембран и микросом печени использовали самцов крыс альбиносов линии Вистар, массой ~250г. Крыс умерщвляли декапитацией без наркоза. Печень извлекали и помещали в предварительно взвешенную среду выделения (t 0°С). После определения массы и проведения перфузии 0.9% NaCl, печень продавливали через пресс и гомогенизировали в стеклянном гомогенизаторе с тефлоновым пестиком в 8-кратном объеме среды выделения, отнесенном к исходному весу ткани.
Сначала осаждали МХ дифференциальным центрифугированием, супернатант центрифугировали на 105000 g 1 час, получившийся осадок наносили на градиент (20, 25, 30, 35% сахароза) крутили 105000g 1 час.
Происходило разделение образца на две четкие зоны, 25-30% микросомы, 20% мембраны.
4.1 Метод отбора высоко- и низкоустойчивых животных
Схема, по которой животные тестировались на устойчивость к гипоксии, была разработана проф. Лукьяновой [Лукьянова и др., 1999; Лукьянова, Коробков, 1981]. В работе использовались самцы крыс линии Вистар массой 250-300 г., которых помещали в барокамеру. Группа высокоустойчивых (ВУ) – животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин.
Глава 5. Результаты и обсуждения
5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии
В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, количество К+ в МХ, а также чувствительность этого транспорта к АТФ у крыс с различной резистентностью к гипоксии.
5.1.1 Изучение параметров дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной резистентностью к гипоксииНесмотря на то, что участие митоКАТФ в защите миокарда и других тканей от ишемических повреждений не вызывает сомнений, механизм позитивного действия активаторов этого канала остается неясным. Для изучения этого вопроса в работе исследовались параметры дыхания и окислительного фосфорилирования в МХ печени и сердца крыс с различной устойчивостью к недостатку кислорода, а также у животных, адаптированных к гипоксии.
Изучение параметров дыхания и окислительного фосфорилирования МХ печени и сердца крыс с различной устойчивостью к гипоксии показало, что скорость дыхания МХ во всех метаболических состояниях у высокоустойчивых животных значительно ниже таковой у низкоустойчивых (Рис.5). Следует отметить, что высокоустойчивые животные – это животные, которые выдерживали острую гипобарическую гипоксию, соответствующую подъему на высоту 11500 м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин.
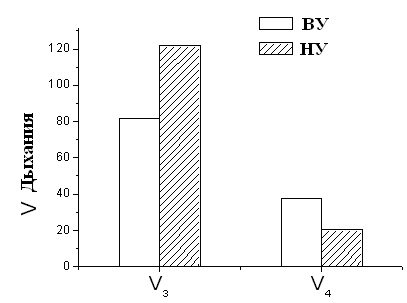
Рисунок 5. Скорость дыхания МХ высоко- и низкоустойчивых к гипоксии
НУ – низкоустойчивые к гипоксии животные, ВУ – крысы, высокоустойчивые к гипоксии. Концентрация белка в кювете – 1-2 мг/мл. Среда инкубации: 5 мМ Tris-HCl, 200 мМ сахарозы, 50 мМ KCl, 5 мМ NaH2PO4, 3 мкМ ротенона, рН 7.2. Эксперименты проводились в закрытой ячейке при постоянном перемешивании и термостатировании при температуре 26°С.
При этом измерение дыхательного контроля времени фосфорилирования АДФ показало, что окислительное фосфорилирование, то есть синтез АТФ происходит более эффективно у высокорезистентных крыс (Рис.6).
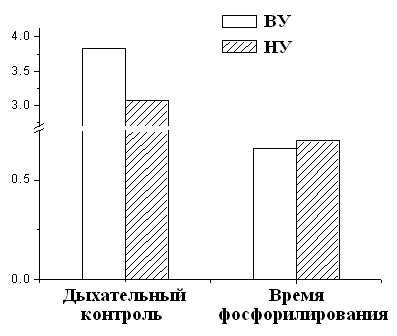
Рисунок 6. Дыхательный контроль и время фосфорилирования МХ крыс с различной устойчивостью к гипоксии
ВУ – высокоустойчивые к гипоксии крысы, НУ – низкоустойчивые к гипоксии животные. Условия как на рис. 7.
Это свидетельствует об исходно меньшей экономичности процесса синтеза АТФ у низкоустойчивых животных. Таким образом, гипоксия, т.е. увеличение функциональной нагрузки на дыхательную цепь МХ при подъеме животных на высоту или при подаче воздуха со сниженной концентрацией кислорода, может привести к истощению резервных возможностей дыхательной цепи, что не происходит у высокоустойчивых животных.
Адаптация низкоустойчивых крыс интервальной нормобарической гипоксией по методу, предложенному в Hypoxia Medical Academy (США), проявляется у них в сопряжении дыхания, что, в свою очередь, выражается в снижении скорости дыхания, увеличении дыхательного контроля и сокращении времени, необходимого для фосфорилирования АТФ (Рис.9).
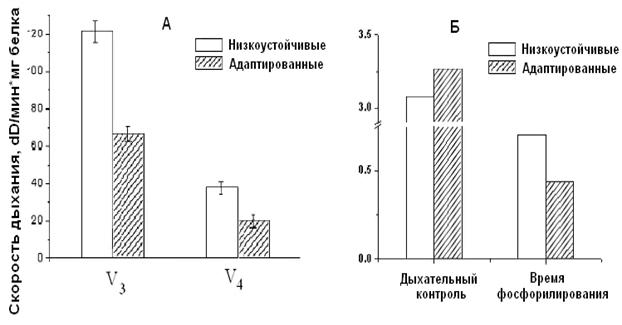 Рисунок 7. Скорость дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и адаптированных к гипоксии
Рисунок 7. Скорость дыхания (А) и время фосфорилирования (Б) МХ сердца крыс низкоустойчивых и адаптированных к гипоксии
Как видно из рис. 7, при адаптации к недостатку кислорода животных низкоустойчивых к гипоксии, скорость дыхания МХ у них уменьшается. Кроме того, у адаптированных крыс сокращается время фосфорилирования и увеличивается значение дыхательного контроля (Рис.9 Б). Эти данные свидетельствуют о возрастании степени сопряженности дыхательной цепи МХ крыс низкоустойчивых к килородному голоданию при гипоксической тренировке.
Следовательно, адаптация приводит к переходу крыс из состояния низкой устойчивости в состояние повышеной устойчивости к гипоксии. Согласно данным Лукьяновой [Лукьянова, 2004] при адаптации крыс гипоксической тренировкой время жизни животного при подъеме на высоту, характеризующее общую неспецифическую резистентность крыс, у НУ животных увеличивается уже после первой тренировки на 120-160% (контроль принят за 0). У НУ время жизни в последующие 20 дней превышает исходную резистентность в 2 раза. У ВУ изменения во времени жизни вообще отсутствуют в первые 7 дней, после чего наблюдается небольшое увеличение, максимум до 40%. В работе делается вывод, что при адаптации гипоксической тренировкой наблюдается экономизация энергетических процессов МХ (Рис. 8).
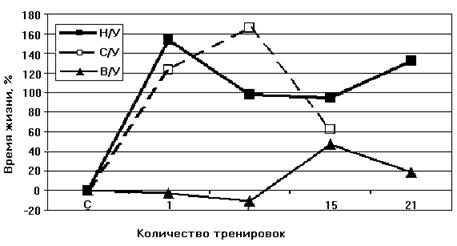
Рисунок 8. Динамика изменения устойчивости к кислородной недостаточности при гипоксической тренировке животных с различной устойчивостью к гипоксии
Н/У – низкоустойчивые крысы, В/У – высокоустойчивые, С/У – животные со средней степенью устойчивости (выдерживающие подъем на высоту в 11500 м в течение 7 минут) [Лукьянова, 2004].
В случае, когда такая оптимизация уже существует, как у высокорезистентных животных, тренировки не приводят к увеличению времени жизни крыс в условиях гипоксии [Лукьянова, 2004]. Поэтому эксперименты по адаптации животных мы проводили на низкоустойчивых к гипоксии крысах.
0 комментариев