Навигация
Изучение параметров АТФ-зависимого транспорта К+ в МХ печени сердца крыс с различной резистентностью к гипоксии
3.1.2 Изучение параметров АТФ-зависимого транспорта К+ в МХ печени сердца крыс с различной резистентностью к гипоксии
В работе были определены параметры АТФ-ингибируемого энергоависимого входа К+ в МХ крыс с различной резистентностью к гипоксии, а также низкоусточивых крыс после их адаптации интервальной нормобарической гипоксической тренировкой. Как следует из рисунка 9А, скорость входа К+ в МХ высокоустойчивых крыс существенно выше, чем в МХ низкоустойчивых животных.
 Рисунок 9. Скорость энергозависимого входа К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии (А), а также в МХ животных, адаптированных к гипоксии Б
Рисунок 9. Скорость энергозависимого входа К+ в МХ печени и сердца крыс с различной устойчивостью к гипоксии (А), а также в МХ животных, адаптированных к гипоксии Б
НУ – низкоустойчивые, ВУ – высокоустойчивые животные. Концентрация МХ белка в ячейке 0.1 мг/мл. Среда инкубации: 50 мМ KCl, 5 мМ HEPES, 5 мМ NaH2PO4, 5мМ янтарной кислоты, 0.5 мМ MgCl2, 0.1 мМ ЭГТА, 5 мкМ цитохрома С, 2 мкM ротенона, 1 мкМ циклоспорина А, рН 7.2. Набухание инициировали добавлением МХ.
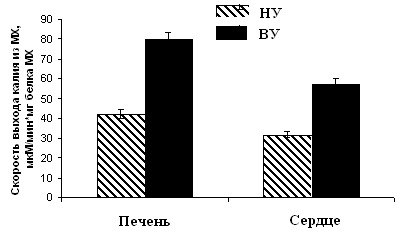
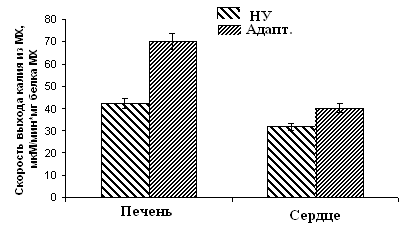
Рисунок 10. Скорость ДНФ-индуцированного выхода ионов К+ из МХ животных высоко-, низкоустойчивых к гипоксии и низкоустойчивых, адаптированных к гипоксии животных
ВУ – высокоустойчивые крысы, НУ – низкоустойчивые, Адапт. – низкоустойчивые, адаптированные к гипоксии. Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Концентрация МХ белка в ячейке составляла 1.5-2 мг/мл. Среда инкубации содержала: 0.3 М сахарозы, 3 мМ NaH2PO4, 10 мМ Трис-HCl, pH 7.4.
Гипоксическая тренировка приводит к увеличению скорости энергозависимого входа К+ до уровня, сравнимого с аналогичными показателями высокорезистентных крыс (Рис.9Б).
Эти данные коррелируют с результатами исследования ДНФ-индуцированного АТФ-зависимого выхода К+ из МХ, измеренного с помощью К+-селективного электрода (Рис. 10).
Следует также отметить, что адаптация приводит к изменению параметров ингибирования канала АТФ. Установлено, что Кi для АТФ в митоКАТФ сердца существенно ниже у адаптированных и высокоустойчивых животных, по сравнению с низкоустойчивыми животными (Таблица 1), что является свидетельством более тонкой регуляции К+ транспорта при адаптации крыс к гипоксии.
Таблица 1. Константа ингибирования АТФ энергозависимого входа К+ в МХ сердца и печени крыс с различной устойчивостью к гипоксии, а также у адаптированных к гипоксии
| Устойчивость к гипоксии | Ki50, мкМ АТФ | |
| Сердце | Печень | |
| Высокоустойчивые | 18.06+5.38 | 51.81+18.05 |
| Низкоустойчивые | 26.30+8.55 | 71.69+8.32 |
| Адаптированные | 17.74+9.85 | 35.74+8.81 |
* Различия достоверны с p<0.05.
При увеличении скорости входа калия в МХ следовало ожидать значительного увеличения количества калия в МХ адаптированных животных, что приводило бы к существенному увеличению объема МХ матрикса. Однако концентрация калия в МХ высокоустойчивых и адаптированных к гипоксии крыс не только существенно не изменилась, но даже уменьшилась (Рис.11А, Б). Это означает, что объем МХ не увеличился, и даже немного сократился. Полученные данные указывают на то, что адаптация, по-видимому, приводит не только к интенсификации энергозависимого входа К+, но и к активации К+/Н+-обменника, который регулирует выход ионов калия из МХ.
Выброс калия из МХ при адаптации животных к гипоксии за счет интенсификации К+/Н+-обменника при активации митоКАТФ позволяет поддерживать постоянный объем МХ и, вероятно, необходим для адаптации животных к гипоксии.
Возможно, при адаптации низкоустойчивых животных к гипоксии важное значение имеет активация не только системы АТФ-зависимого входа К+ в мтиохондрии, но и системы выхода этого иона. При этом снижение активности К+/Н+-обменника может быть причиной высокоамплитудного набухания и следующего за ним повреждения МХ при ишемии.
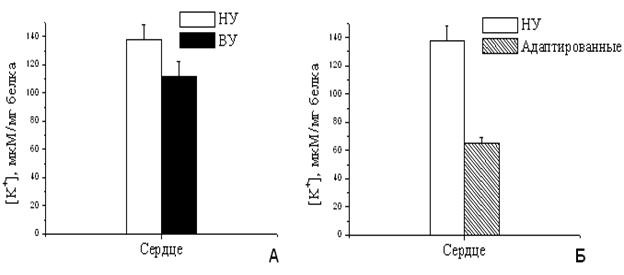 Рисунок 11. Количество К+ в МХ сердца крыс с различной резистентностью (А) и адаптированных к гипоксии (Б)
Рисунок 11. Количество К+ в МХ сердца крыс с различной резистентностью (А) и адаптированных к гипоксии (Б)
Измерения проводились при постоянном перемешивании и термостатировании при 26°С. Условия как на рис. 10.
Известно, что при гипоксии недостаток кислорода приводит к восстановлению переносчиков дыхательной цепи, поскольку сток электронов на кислород затруднен [Лукьянова, 2004].
В соответствии с литературными данными восстановление переносчиков, локализованных на I и III комплексах дыхательной цепи, приводит к увеличению образования активных форм кислорода (АФК) [Kaplan-Bresler, 1965; Ferranti et al., 2003]. Как было показано ранее, главным участком образования АФК являются связанные с белком убисемихиноны, которые сопряжены по спину с железо-серным кластером [Ohnishi et al., 2005].
МХ превращают несколько процентов потребляемого кислорода в АФК [Lenaz et al., 2002]. Как было показано ранее, небольшие концентрации АФК необходимы для функционирования дыхательной цепи [Kondrashova and Mironova, 1971]. В то же время, повышенное образование АФК при гипоксии служит основным повреждающим фактором [Starkov et al., 1997; Barger et al., 2002].
Обнаруженная нами активация калиевого цикла, способствует слабому разобщению митохондрий и снижению мембранного потенциала. Известно, что незначительное снижение мембранного потенциала (~13%) ведет к существенному уменьшению продукции АФК (до 80%) [Korshunov et al., 1997]. Кроме того, было установлено, что активация канала сопровождается снижением концентрации АФК в клетке, способствуя сохранению уровня АТФ [Zweier et al., 1987; Pain et al., 2000].
Этот предполагаемый механизм может объяснить защитную роль митоКАТФ канала при реперфузии. Хорошо известно, что АФК являются основным повреждающим фактором при ишемии/реперфузии [Pearlstein et al., 2002; Li et al., 2002], а активация митоКАТФ канала приводит к сокращению уровня образования АФК во время фазы реперфузии [Zweier et al., 1987; Ozcan et al., 2002]. Полученные данные подтверждают развиваемую в лаборатории проф. Лукьяновой концепцию, что адаптация к гипоксии идет на фоне снижения свободнорадикальной активности, а не ее увеличения [Лукьянова, 2004].
Таким образом, полученные в работе результаты позволили доказать важную роль митоКАТФ в формировании устойчивости организма к кислородному голоданию, а также в адаптации животных к гипоксии. В работе предлагается также возможный механизм формирования такого типа адаптации.
0 комментариев