Навигация
ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
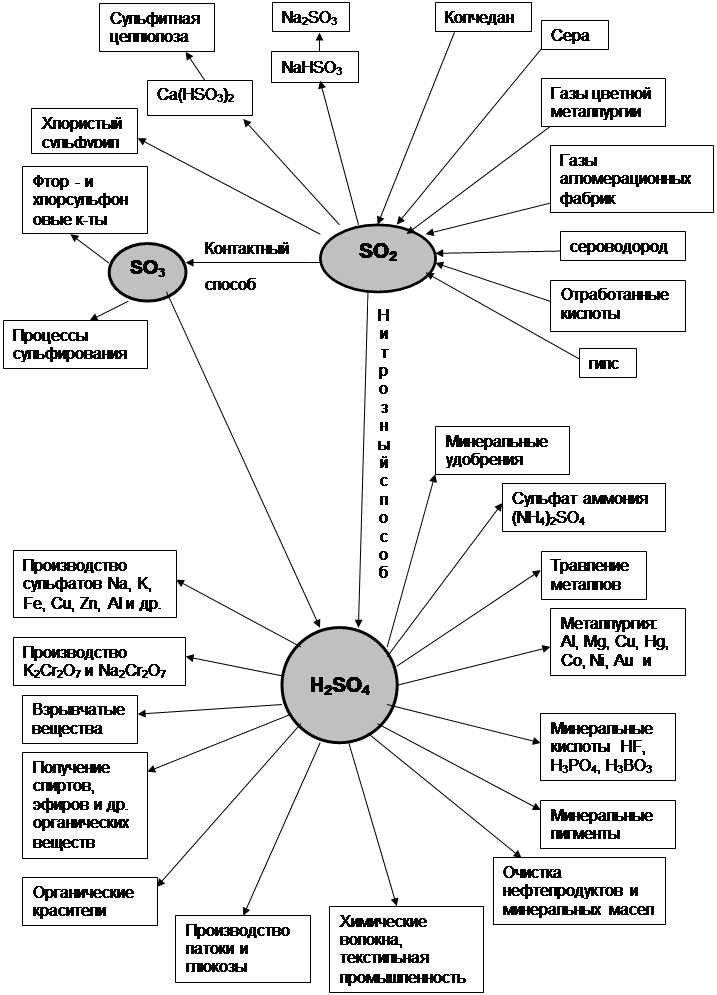
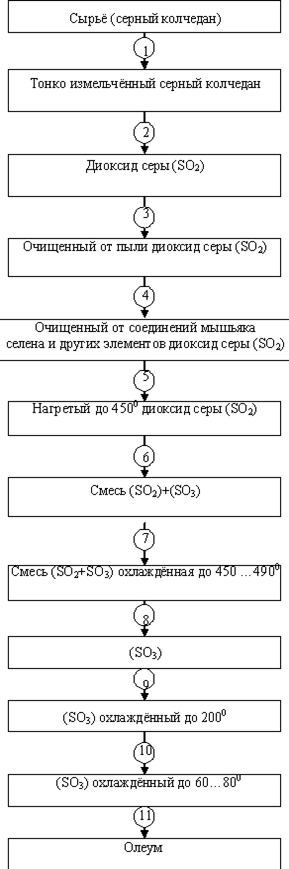
2 ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
2.1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ
При установившемся в денитрационной колонне ГБХ (поз.1) равновесном процессе, HNO3 из смеси кислот, поступающей в колонну (поз.1) на тарелку испарения, частично уходит на нижележащие тарелки, откуда снова отгоняется на тарелку испарения. В процессе дистилляции, то есть отгонки HNO3 из тройной смеси, поднимающиеся вверх пары обогащаются более летучим компонентом – HNO3, а в движущуюся вниз жидкость переходит менее летучий компонент – вода.
Процесс испарения HNO3 происходит /3/ главным образом в средней части колонны (поз.1). Серная кислота, пройдя эту зону, содержит в себе растворенные окислы азота, переходящие из тройной смеси. Даже если в тройной смеси не было бы растворенных окислов азота, то при частичном разложении HNO3 происходит выделение окислов, которые взаимодействуя с H2SO4, образуют нитрозилсерную кислоту:
2H2SO4 + N2O3 = 2HNSO5 + H2O + 86250 Дж (2.1)
Диоксид или четырехоксид азота, реагируя с концентрированной H2SO4, образует нитрозилсерную кислоту и азотную кислоту:
2NO2 + H2SO4 = HNSO5 + HNO3 (2.2)
Процесс разложения нитрозилсерной кислоты с выделением окислов азота характеризуется как процесс денитрации. Однако термин "денитрация" служит для обозначения процесса, обратного этерификации. В данном случае более правильно процесс разложения нитрозилсерной кислоты называть процессом гидролиза:
2HNSO5 + 2H2O = 2H2SO4 + 2HNO2 (2.3)
2HNO2 = H2O + N2O3(жид) (2.4)
N2O3(жид) = N2O3(газ) (2.5)
N2O3(газ) = NO (газ) + NO2 (газ) (2.6)
Азотистая кислота (HNO2), образующаяся при гидролизе по реакции (2.3) неустойчива и распадается:
2HNO2 = H2O + HNO3 + 2NO (2.7)
Нитрозилсерная кислота является довольно стойким соединением, которое при концентрациях H2SO4 выше 70% не разлагается полностью даже при температуре кипения. При разбавлении H2SO4 водой происходит гидролиз нитрозилсерной кислоты, степень которой увеличивается с понижением концентрации H2SO4 и повышением температуры.
Таблица 2.1 – Зависимость степени разложения HNSO5 от концентрации H2SO4 при 15-20 ºС
Концентрация H2SO4, % | Степень разложения HNSO5 , % | Концентрация H2SO4, % | Степень разложения HNSO5 , % |
98 95 92 90 | 1,1 4,0 7,3 12,4 | 81 80 70 57,5 | 19,4 27,7 49,8 100,0 |
Как видно из зависимости, начиная с концентрации 57,5% серной кислоты, нитрозилсерная кислота совершенно отсутствует. Отработанная серная кислота, выходящая из колонны (поз.1), должна содержать минимально возможное количество окислов азота. Это необходимо не только для исключения потерь N2O3, но и устранения нитрозилсерной кислоты, обладающей сильно разрушающими свойствами.
Поэтому гидролиз нитрозилсерной кислоы в колонне ГБХ (поз.1) /1/ является важной стадией процесса. С увеличением температуры, степень гидролиза нитрозилсерной кислоты увеличивается. Образующийся при разложении азотистой кислоты монооксид азота незначительно растворяется в разбавленной серной кислоте. Гидролиз нитрозилсерной кислоты ведут с помощью перегретого до 250 ºС водяного пара, который подается с таким расчетом, чтобы разбавление кислоты конденсатом соответствовало массовой доли H2SO4 68 – 70 %. В отработанной серной кислоте содержится до 0,03% азотной кислотыи растворенных окислов азота. Последние образуют с серной кислотой до 0,01 % нитрозилсерной кислоты.
После стадии денитрации разбавленная серная кислота отправляется на стадию концентрирования /3/. В процессе концентрирования разбавленной серной кислоты, имеющиеся в ней примеси, в частности, продукты неполного сгорания топлива (когда концентрирование ведется непосредственным соприкосновением упариваемой кислоты с топочными газами), вызывают разложение серной кислоты вследствие ее восстановления до SO2. Восстановление в основном идет за счет углерода, содержащегося в примесях и в топливе по реакции:
2H2SO4 + С = СО2 + 2SO2 + 2 H2O (2.8)
За счет этого происходят некоторые потери кислоты при ее упаривании. В процессе разгонки тройной смеси в колонне образуются нитрозные газы, которые поступают на поглощение в абсорбер (поз.4). Наиболее распространенный способ поглощения нитрозных газов – водой с образованием слабой HNO3. На поглощение поступают нитрозные газы различной степени окисления. Окислы азота, содержащиеся в нитрозных газах NO2, N2O4, N2O3 реагируют с водой
2NO2 + H2O = HNO3 + HNO2 + 116 кДж (2.9)
N2O4 + H2O = HNO3 + HNO2 + 59,2 кДж (2.10)
N2O3 + H2O = 2HNO3 + 55,6 кДж (2.11)
Процесс поглощения нитрозных газов водой связан с растворением в ней диоксида азота, четырехоксида и трикосида азота с образованием HNO3 и азотистой кислоты.
В газовой среде вследствие взаимодействия паров воды с нитрозными газами, также получается HNO3 и азотистая кислота. Образовавшаяся при помощи нитрозных газов азотистая кислота – малоустойчивое соединение, которое разлагается по реакции:
2HNO2 = HNO3 + 2NO + H2O – 75,8 кДж (2.12)
Суммарная реакция образования HNO3:
2NO2 + H2O = HNO2 + HNO3 (2.13)
3HNO2 = HNO3 + 2NO + 2H2O (2.14)
____________________________________
3NO2 + H2O = 2HNO3 + NO (2.15)
N2O3 + H2O = 2HNO2 (2.16)
3HNO2 = HNO3 + H2O + 2NO (2.17)
______________________
3N2O3 + H2O = 2HNO3 + 4NO (2.18)
Так как в нитрозных газах содержится незначительное количество триоксида азота, обычно технологические расчеты производят по NO2. Как видно из реакций (2.12) – (2.18) 2/3 поглощенного диоксида азота идет на образование HNO3, 1/3 его выделяется в виде монооксида азота.
Отсюда следует, что при поглощении водой нитрозных газов невозможно все количество NO2 превратить в HNO3, так как в каждом цикле всегда 1/3 NO х будет выделяться в газовую фазу.
Однако указанные поглощения не являются совершенными и нитрозные газы перед выбросом в атмосферу следует дополнительно очистить от окислов азота.
Отсюда следует, что в последнем абсорбере орошение ведется не водой, а азотной кислотой с массовой долей 5 %, которая до 0,003% поглощает окислы азоты. Выбрасываемые в атмосферу газы при этом соответствуют санитарным нормам, т.е. не превышают установленных ПДК.
Похожие работы
... Содержание прокаленного остатка, в % 0,4 4. Содержание окислов азота N2O3, в %, не более 0,01 5. Содержание железа, в %, не более 0,2 3. Отработанные и вытесненные кислоты представляют собой тройную смесь азотной и серной кислот, а также воды. Таблица №5 - Состав тройных смесей № Наименование составных частей Отработанной кислоты Вытесненной кислоты 1. Азотная ...
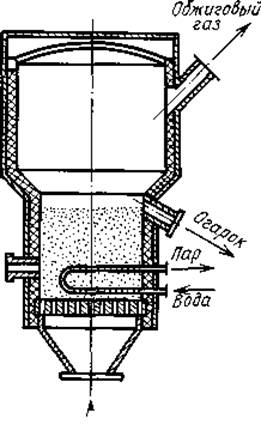
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
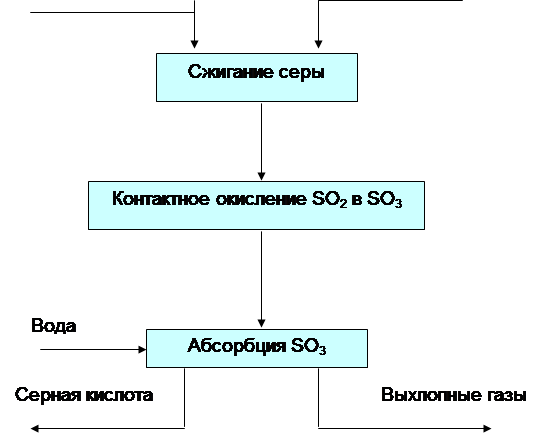
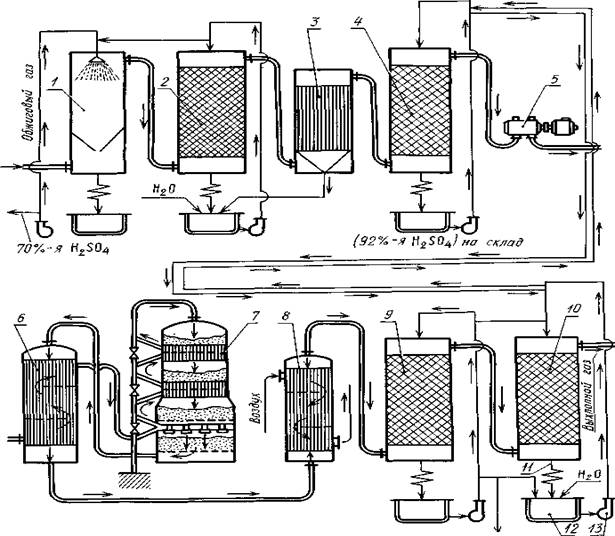
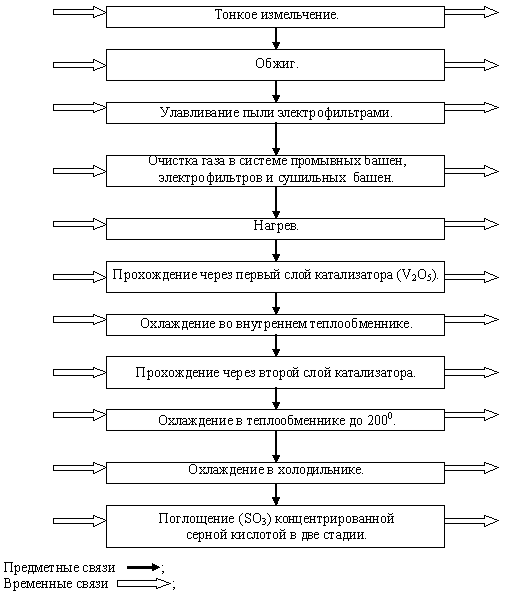
... между трубками теплообменников, расположенных в контактном аппарате между полками с контактной массой, нагревается до 450 °С и поступает на верхний слой катализатора, где 70...75 % Рис. 2.2. Схема производства серной кислоты контактным способом: 1, 2—промывные башни (полая и с насадкой); 3 — электрофильтр; 4 — башня с насадкой; 5 - турбокомпрессор; 6 - теплообменник; 7 — контактный аппарат; ...
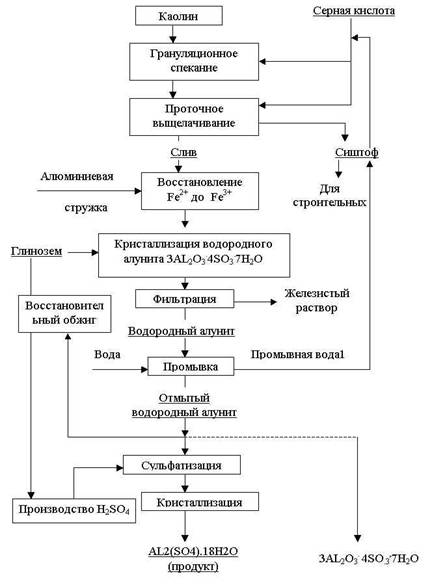
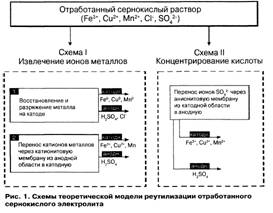
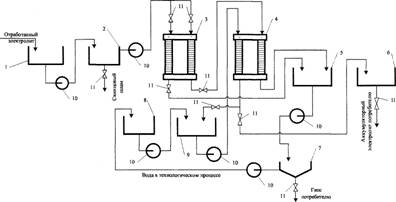
... 300 С ). Недостатком схемы является большой расход щелочи и сложность регенерации ее из шлама [ 3 ]. Глава 2. Обеспечение экологической безопасности путем разработки малоотходного способа реутилизации сернокислых отходов аккумуляторных батарей Экологическая безопасность и эффективное функционирование экономики каждого государства неразрывно связаны с транспортной отраслью. Транспортные ...
0 комментариев