Навигация
Слабая серная кислота с массовой долей 70 %
6. Слабая серная кислота с массовой долей 70 %.
В колону поступает с кислотной смесью моногидрата H2SO4 – 154 кг и 1900 кг с массовой долей 92 %. Тогда жидкостная нагрузка по серной кислоте:
G ´3 = 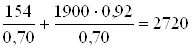 кг
кг
При этом с этой кислотой уносится воды:
g 3 = 30 % · G ´3 , (кг) (3.15)
G ´3 – жидкостная нагрузка по серной кислоте, кг.
g 3 = 0,3 · 2720 = 816 кг. Принимаем g 3 = 820 кг.
В результате гидролиза получается следующее количество сухих нитрозных газов (без учета подсоса воздуха):
O2 = NO2 = 2,72 + 5,45 + 5,43 = 13,6 кг
или NO2 = 13,6 ∙ 22,4 / 46 = 6,62 нм
NO = 3,55 + 3,54 = 7,09 кг
или NO = 7,09 · 22,4 / 30 = 5,3 нм
N2 = 0,53 + 0,53 = 1,06 кг
или N2 = 1,06 ∙ 22,4 / 28 = 0,85 нм
O2 = 0,47 + 2,36 = 2,83 кг
или O2 = 2,83 · 22,4 / 32 = 1,981 нм
HNO3 = 2,48 кг
HNO3 = 2,48 · 22,4 / 63 = 0,88 нм
Всего: 24,58 кг или 14,76 нм.
4. Воздух, подсасываемый из помещения:
Принимаем, что подсасываемый воздух поступает при t = 20 ºС с относитель-ной влажностью 70%. Подсос воздуха через неплотности соединений царг принимаем равным 100 % объема сухих газов. Тогда V подс = 14,76 нм..
В том числе:
N2 = с 1 ∙ V подс , (нм) (3.16)
где с 1 = 78 % - массовая доля азота в сухом воздухе /5/; V подс – объем воздуха, подсасываемый через неплотности соединений царг, нм.
N2 = 0,78 ∙ 14,76 = 11,51 нм
O2 = с 2 · V подс , (нм) (3.17)
где с 2 = 21 % - массовая доля кислорода в сухом воздухе /5/; V подс – объем воздуха, подсасываемый через неплотности соединений царг, нм.
O2 = 0,21 · 14,76 = 3,10 нм.
Или N2 = 11,51 ∙ 28 / 22,4 = 14,40 кг
O2 = 3,10 ∙ 32 / 22,4 = 4,43 кг
Итого: 18,83 кг.
Масса водяных паров, поступающих в колонну с воздухом:
М Вод. пар. =18,83 · 0,01042 = 0,2 кг
где d 0 = 10,42 г/ кг сухого воздуха – влагосодержание
Количество и состав сухих газов, выходящих из колонны с учетом подсоса воздуха:
NO2 = 2,72 + 5,45 + 5,43 = 13,6 кг
или NO2 = 13,6 ∙ 22,4 / 46 = 6,62 нм
NO = 3,55 + 3,54 = 7,09 кг
или NO = 7,09 · 22,4 / 30 = 5,3 нм
N2 = 0,53 + 0,53 + 14,40 = 15,46 кг
или N2 = 15,46 ∙ 22,4 / 28 = 12,37 нм
O2 = 0,47 + 2,36 + 4,43 = 7,26 кг
или O2 = 7,26 · 22,4 / 32 = 5,10 нм
HNO3 = 2,48 кг
HNO3 = 2,48 · 22,4 / 63 = 0,88 нм
Итого: 45,89 кг или 30,27 нм.
Количество паров воды, уходящих из колонны с нитрозными газами при t = 35 ºС, определяем по формуле:
H2O = 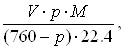 (кг) (3.18)
(кг) (3.18)
где V = 30,27 нм 3 – объем сухих газов; р – парциальное давление паров воды /5/, МПа; М – молекулярная масса воды, кг/моль.
р = 1,8 мм. рт. ст – парциальное давление воды над 98 % HNO3 при t = 35 ºС
p = 133.3 · 1.8 = 239.9 Па
H2O = 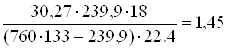 кг
кг
или в объеме
![]() нм
нм
Общий состав и количество газов, выделившихся из системы гидролиза и поступающих на поглощение:
NO2 = 13,6 кг или NO2 = 6,62 нм
NO = 7,09 кг или NO = 5,3 нм
N2 = 15,46 кг или N2 = 12,37 нм
O2 = 7,26 кг или O2 = 5,10 нм
HNO3 = 2,48 кг или HNO3 = 0,88 нм
H2O = 1,45 кг или H2O = 1,80 нм
Итого: 45,89 кг или 30,27 нм.
На основании полученных данных в таблице 3.1 приведен сводный баланс воды при регенерации кислотной смеси, в таблице 3.2 приведен сводный баланс по кислотам и нитрозным газам.
Таблица 3.1 – Сводный баланс воды при регенерации 1 тонны кислотной смеси
Приход | Масса, кг | Расход | Расход, кг |
1. С перерабаты – ваемой кислотной смесью 2. С серной кислотой с массо – вой долей 92 % 3. С перегретым паром | 583
152
90
| 1. С отработанной серной кислотой
2. С парами азотной кислоты с массовой долей 98 %
| 820
5 |
Итого: | 825 | Итого: | 825 |
Таблица 3.2 – Сводный баланс по кислотам и нитрозным газам при регенерации 1 тонны кислотной смеси
Приход | Масса, кг | Расход | Расход, кг |
1 | 2 | 3 | 4 |
1. С азотной кислотой с массовой долей 50 % 2. С перерабаты-ваемой кислотной смесью
3. С серной кислотой с массовой долей 92 % 4. С воздухом с учетом влаги 5. С водой в виде подогретого пара | 333,40
666,60
1900
20,63
88,26 | 1. С азотной кислотой с массовой долей 96 % 2. С отработанной серной кислотой с массовой долей 70 % 3. С нитрозными газами с учетом подачи воздуха
| 243
2720
45,89
|
Итого: | 3008,89 | Итого: | 3008,89 |
3.1.2 МАТЕРИАЛЬНЫЕ РАСЧЕТЫ ОТДЕЛЕНИЯ КОНЦЕНТРИРОВАНИЯ ОТРАБОТАННОЙ СЕРНОЙ КИСЛОТЫ
Для расчета принимаем следующие исходные данные:
Производительность концентратора по моногидрату H2SO4 – 31,5 тонн;
Массовая доля продукционной кислоты – 92 %;
Массовая доля отработанной серной кислоты, поступающей на концентрирова-ние – 70 %;
Потери серной кислоты с отходящими газами – 1,5 %;
Приход:
1. В вихревую колонну поступает разбавленная /3/ серная кислота с учетом 0,06 % потерь:
Gразб = G · (1 – 0,0006), (кг) (3.19)
Gразб = 7654,87 · 0,9994 = 7650,28 кг
в том числе воды:
GH2O = Gразб · (1 – w / 100), (кг) (3.20)
GH2O = 7650,28 · (1 – 0,7) = 2295,08 кг
2. Топочные газы:
Соотношение серной кислоты с массовой долей 70 % и топочных газов равно 3:1. Следовательно, масса топочных газов, поступивших в колонну на концентрирование 70 % - ной серной кислоты: m = 2600 кг.
3. Вода, поступившая в концентратор на абсорбцию:
GH2O´ = 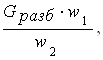 (кг), (3.21)
(кг), (3.21)
где Gразб – количество серной кислоты, поступившей на концентрирование, кг; w1 – массовая доля воды, содержащейся в разбавленной серной кислоте, %; w 2 – массовая доля серной кислоты, поступившей на концентрирование, %.
GH2O´ = ![]() = 3278,7 кг
= 3278,7 кг
Расход:
1. При концентрировании серная кислота разлагается по формуле:
H2SO4 = SO2 + H2O + ½ O2 (3.6)
Потери от разложения составляют 50% общих потерь или 0,03 %:
Gпот = 0,03 % · G разб, (кг) (3.22)
Gпот = G разб · 0,03 / 100 = 7650,28 · 0,0003 = 2,3 кг.
2. Потери вследствие уноса серной кислоты с дымовыми газами составляют
также 50% общих потерь (0,03%):
G ун = 0,03 % · G разб, (кг) (3.23)
Gун = 0,0003 ∙ 7650,28 = 2,3 кг.
2. Общие потери составляют:
Gпот = Gун + Gразл , (кг) (3.24)
Gпот = 2,3 + 2,3 = 4,6 кг.
4. При разложении серной кислоты образуется:
H2SO4 = SO2 + H2O + ½ O2 (3.7)
SO2 = (МSO2 / М H2SO4 ) · Gун , кг, (3.25)
где М H2SO4 – молекулярная масса серной кислоты, кг/моль; М SO2 – молекулярная масса оксида серы (VI), кг/моль; G ун – потери вследствие уноса серной кислоты с дымовыми газами, кг.
SO2 = (64 / 98) · 2,3 = 1,5 кг
H2O = (МН2О / М H2SO4 ) · Gун , (кг) (3.26)
где М H2O – молекулярная масса воды, кг/моль; М Н2SO4 – молекулярная масса серной кислоты, кг/моль; G ун – потери вследствие уноса серной кислоты с дымовыми газами, кг.
Н2O= (18 / 98) · 2,3 = 0,42 кг
O2 = (0,5 · МО2 / М H2SO4 ) · Gун , (кг) (3.27)
где М H2O – молекулярная масса воды, кг/моль; М Н2SO4 – молекулярная масса серной кислоты, кг/моль; G ун – потери вследствие уноса серной кислоты с дымовыми газами, кг.
O2 = (0,5 · 32 / 98) · 2,3 = 0,38 кг,
5. В колонне выпаривается воды:
Gвых = Gразб · [(1 – w 3 / 100) – (1 – w 4 / 100)], (кг) (3.28)
где Gразб – количество серной кислоты, поступившей на концентрирование, кг; w1 – массовая доля разбавленной серной кислоты, %; w 2 – массовая доля концентрированной серной кислоты, %.
Gвых = 7650.28 · [(1 – 70 / 100) – (1 – 92 / 100)] = 1606,56 кг
На процесс абсорбции поступает вода в количестве 3278,7 кг. При этом на поглощение газов затрачивается по 5 % на каждой абсорбционной ступени, т. е. 15 % от общего количества воды и равно 491,81 кг. Остальное количество воды выходит из колонны.
6. Выход 92% продукционной H2SO4:
Gкон= G разл – Gвых , (кг) (3.29)
Gкон= 7650.28 – 1606.56 = 6043,76 кг.
7. Приход кислоты по моногидрату (конденсат):
G конд = Gразб · (1 – w 3 / 100), (кг) (3.30)
G конд = 7650,28 ∙ 0,7 = 5355,2 кг
В таблице 3.3 приведен сводный баланс отделения концентрирования серной кислоты.
Таблица 3.3 – Сводный баланс концентрирования серной кислоты.
Приход | Масса, кг | Расход | Масса, кг |
1 | 2 | 3 | 4 |
1. С серной кислотой с массовой долей 70 % 2. Топочные газы С температурой 900 ºС 3. Вода, поступающая на концентрирование | 7650,28
2600
5573,78
| 1. Потери вследствие уноса серной кислоты с дымовыми газами 2. При разложении серной кислоты 3. В колонне выпаривается воды 4. Выход 92% продукционной серной кислоты 5. Приход кислоты по моногидрату 6. Выход отработанной воды | 2,3
2,3
1606,56
6043,76
5355,2
2786,90 |
Итого: | 15797,02 | Итого: | 15797,02 |
3.2 ТЕПЛОВЫЕ РАСЧЕТЫ
3.2.1 ТЕПЛОВЫЕ РАСЧЕТЫ ОТДЕЛЕНИЯ ДЕНИТРАЦИИ И КОНЦЕНТРИРОВАНИЯ АЗОТНОЙ КИСЛОТЫ
Исходные данные:
1. Температура отработанной кислотной смеси, поступающей в колонну,
t = 90 ºС.
2. Температура азотной кислоты с массовой долей 50 %, поступающей в колонну,
t = 20 ºС.
3. Температура серной кислоты с массовой долей 92%, поступающей в колонну,
t = 20 ºС.
4. Температура отработанной серной кислоты 70%, выходящей из колонны,
t = 170 ºС.
5. Температура выходящих из колонны паров азотной кислоты и нитрозных газов
t = 85ºС.
6. Температура азотной кислоты 98%, выходящей из конденсатора, поступающей в колонну, t = 40 ºС.
7. Температура концентрированной азотной кислоты с массовой долей 98%, выходящей из колонны, t = 85 ºС.
8. Температура подсасываемого воздуха t = 20 ºС
Общий вид уравнения теплового баланса:
Q приход = Q расход , (кДж) (3.31)
Приход теплоты:
Q приход = q 1 + q 2 + q 3 + q 4 + q 5 + q 6, (кДж) (3.32)
где q 1 – теплота от поступающей серной кислоты с массовой долей 92 %.
Теплота от серной кислоты состоит из физической теплоты q 1´ и теплоты разбавления q 1´´:
q 1 = q 1´ + q 1´´, (кДж) (3.33)
Физическая теплота определяется по формуле:
q 1´ = G ´ · c 1 ∙ t, кДж, (3.34)
где - G ´– масса серной кислоты с массовой долей 92 %, поступающей в колонну, кг; с 1 – удельная теплоемкость серной кислоты с массовой долей 92 % при температуре 20 ºС, кДж / (кг · К) /6/; t – температура поступающей в колонну серной кислоты, К.
q 1´ = 1900 · 1,579 ∙ 293 = 979235,3 кДж
Теплота разбавления серной кислоты q 1´´ определяется разницей теплот разбавления моногидрата серной кислоты до массовой доли 70 %:
q 1´´ = q 70 + q 92, кДж, (3.35)
q 70 – теплота разбавления серной кислоты с массовой долей 70 %; q 92 – теплота разбавления серной кислоты с массовой долей 92 %.
Удельная теплота разбавления моногидрата:
![]() , (кДж) (3.36)
, (кДж) (3.36)
где – молярное отношение H2O : H2SO4.
Находим n для серной кислоты с массовыми долями 92 % и 70 %.
В серной кислоте с массовой долей 92 % содержится:
H2SO4 = ![]() , (моль) (3.37)
, (моль) (3.37)
где – G ´– масса серной кислоты с массовой долей 92 %, поступающей в колонну, кг; w – концентрация серной кислоты, %; М – молекулярная масса серной кислоты, кг / моль.
H2SO4 = ![]() моль
моль
H2O = ![]() , (моль) (3.38)
, (моль) (3.38)
где – G ´– масса серной кислоты с массовой долей 92 %, поступающей в колонну, кг; w – содержание воды в 92 % серной кислоте, %; М – молекулярная масса воды, кг / моль.
H2O = ![]() моль
моль
Отсюда n = 8,44 / 17,8 = 0,47
В серной кислоте с массовой долей 70 % содержится:
H2SO4 = ![]() , (моль) (3.39)
, (моль) (3.39)
где – G ´– масса серной кислоты с массовой долей 70 %, поступающей в колонну, кг; w – концентрация серной кислоты, %; М – молекулярная масса серной кислоты, кг / моль.
H2SO4 = ![]() моль
моль
H2O = ![]() , (моль) (3.40)
, (моль) (3.40)
где – G ´– масса серной кислоты с массовой долей 70 %, поступающей в колонну, кг; w – содержание воды в 70 % серной кислоте, %; М – молекулярная масса воды, кг / моль.
H2O = ![]() моль
моль
Отсюда n = 45,33 / 19,42 = 2,33
Тогда удельная теплота разбавления серной кислоты с массовой долей 100 % до массовой доли 70 %:
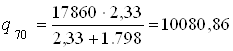 ккал / моль (42238,80 кДж / моль)
ккал / моль (42238,80 кДж / моль)
и до массовой доли 92 %:
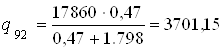 ккал / моль (15507,82 кДж /моль)
ккал / моль (15507,82 кДж /моль)
Следовательно, удельная теплота разбавления серной кислоты с массовой долей 92 % и 70 % составит:
![]() кДж / моль
кДж / моль
Или на 1 т отработанной кислоты:
q 2´´ = 17,8 · 26730,98 = 475811,44 кДж
Тогда на 1 т отработанной серной кислоты приход теплоты:
q 1 = 979235,3 + 475811,44 = 1455046,74 кДж
Физическая теплота, поступающая с азотной кислотой с массовой долей 50 %:
q 2 = G 2 · с 2 ∙ t 2 , (кДж) (3.41)
где – G2 – масса азотной кислоты с массовой долей 50 %, поступающей в колонну, кг; с 2 – удельная теплоемкость азотной кислоты с массовой долей 50 % при температуре 20 ºС, кДж / (кг · К) /7/; t – температура поступающей в колонну азотной кислоты, К.
q 2 = 333,40 · 2,847 ∙ 293 = 278112,61 кДж
Физическая теплота, поступающая с отработанной кислотной смесью:
q 3 = G 3 · с 3 ∙ t 3 , (кДж) (3.42)
где – G 3 – масса кислотной смеси, поступающей в колонну, кг; с 3 – удельная теплоемкость кислотной смеси при температуре 90 ºС, кДж / (кг · К) /2/; t 3 – температура поступающей в колонну кислотной смеси, К.
q 3 = 666,60 · 2,22 ∙ 363 = 537186,28 кДж
Физическая теплота, поступающая с азотной кислотой с массовой долей 98 %, поступающей из конденсатора в зону отдувки:
q 4 = G 4 · с 4 ∙ t 4 , (кДж) (3.43)
где – G 4 – масса азотной кислоты, поступающей в колонну, кг; с 4 – удельная теплоемкость азотной кислоты при температуре 30 ºС, кДж / (кг · К) /7/; t 4 – температура поступающей в колонну азотной кислоты, К.
q 4 = 243 · 1,93 ∙ 303 = 142103,97 кДж
Физическая теплота, поступающая с воздухом, подсасываемым из помещения:
q 5 = G 5 · с 5 ∙ t 5 , (кДж) (3.44)
где – G 5 – масса воздуха, поступающего в колонну, кг; с 5 – удельная теплоемкость воздуха, кДж / (кг · К) /5/; t 5 – температура поступающей в колонну азотной кислоты, К.
q 5 = 18,83 · 1 ∙ 293 = 5517,20 кДж
Физическая теплота, поступающая с перегретым паром равна q 6.
Итого: Q приход = 1455046,74 + 278112,61 + 537186,28 + 142103,97 + 5517,20 + q 6
Расход теплоты:
Q расход = q 1´ + q 2´+ q 3´+ q 4 ´+ q 5 ´+ q 6´ + q 7´ + q 8´ + q 9´ , (кДж) (3.45)
где q 1´ - теплота на закрепление содержащейся в отработанной кислоте азотной кислоты при ее массовой доле в смеси:
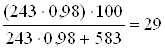 %
%
до массовой доли 98 %
Удельная теплота разбавления для азотной кислоты:
![]() , (кДж) (3.46)
, (кДж) (3.46)
В кислоте с массовой долей 29 %, моль:
HNO3 = ![]() 1,08 моль
1,08 моль
H2O = ![]() 9,20 моль
9,20 моль
Отсюда n = 9,20 / 1,08 = 8,52. Принимаем n = 8,5.
Удельная теплота разбавления для азотной кислоты с массовой долей 29 %:
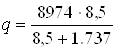 = 7451,3 ккал / моль (31220,96 кДж/моль)
= 7451,3 ккал / моль (31220,96 кДж/моль)
Теплота разбавления для азотной кислоты с массовой долей 98 %. В кислоте, моль:
HNO3 = ![]() 0,020 моль
0,020 моль
H2O = ![]() 0,01 моль
0,01 моль
Отсюда n = 0,01 / 0,020 = 0,5. Принимаем n = 0,5.
Теплота разбавления:
q ´ = 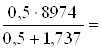 2005,81 ккал/моль (8704,35 кДж/моль)
2005,81 ккал/моль (8704,35 кДж/моль)
Теплота закрепления азотной кислоты, находящейся в отработанной кислоте с 29 % до массовой доли 98 %:
q 1´ = (31220,96 – 8704,35) · (233,28 / 63) = 83309,2 кДж
Физическая теплота, уносимая парами кислоты с массовой долей 98 % из колонны при 85 ºС:
q 2´ = 0,97 ∙ G 2´ · с 2´ ∙ t 2´ , (кДж) (3.47)
где – G 2´ – масса азотной кислоты, поступающей в колонну, кг; с 2´ – удельная теплоемкость азотной кислоты при температуре 85 ºС, кДж / (кг · К) /7/; t 2´ – температура, поступающей в колонну азотной кислоты, К.
q 2´ = 0,97 · 243 · 1,936 ∙ 358 = 163367,77 кДж
Расход теплоты на испарение азотной кислоты:
q 3´ = 0,97 ∙ 243 i, (кДж) (3.48)
где – i – теплота испарения 1 кг кислоты, кДж / кг.
q 3´ = 0,97 · 243 · 483 = 113847,93 кДж
Расход теплоты на испарение 2 % воды, содержащейся в азотной кислоте:
q 4´ = 0,97 · 2 / 98 · 243 i 1 , (кДж) (3.49)
где – i 1 – теплота парообразования воды, кДж / кг.
q 4´ = 0,97 · 2 / 98 · 243 · 2259 = 10866,71 кДж,
Физическая теплота, уносимая с отработанной серной кислотой с массовой долей 70 % из колонны при 170 ºС:
q 5´ = G 3´ · с 5´ ∙ t 5´, (кДж) (3.50)
где – G 3´ – масса серной кислоты, поступающей в колонну, кг; с 2´ – удельная теплоемкость серной кислоты с массовой долей 70 %, кДж / (кг · К) /6/; t 2´ – температура серной кислоты, выходящей из колонны, К.
q 5´ = 2720 · 2,09 ∙ 443 = 2518366,4 кДж
Расход теплоты на нагревание подсасываемого воздуха в среднем до 90 ºС:
q 6´ = g подс ∙ с · (t 2 – t 1), (кДж) (3.51)
где – с – удельная теплоемкость воздуха, кДж / кг ∙ К; t 1 – температура подсасываемого воздуха, К.
q 6´ = 18,83 · 1 ∙ (363 – 273) = 1694,7 кДж
Расход теплоты, уносимой с азотной кислотой с массовой долей 98 % из колонны при температуре 85 ºС:
q 7´ = G 2´ ∙ с · t , (кДж) (3.52)
где – с – удельная теплоемкость азотной кислоты при температуре 85 ºС, кДж / кг ∙ К /7/; t 1 – температура уходящей азотной кислоты из колонны, К.
q 7´ = 243 · 1,93 ∙ 358 = 167898,42 кДж
Расход теплоты в окружающую среду:
Колонна типа ГБХ в течение 1 часа теряет в окружающую среду порядка 33520 кДж. При условии подачи в колонну 92 кг / мин тройной кислотной смеси потери теплоты в окружающую среду:
q ´8 = ![]() 6072,46 кДж
6072,46 кДж
Теплота, уносимая нитрозными газами q ´9:
q 9´ = ∑ q 9i´, (кДж) (3.53)
где ∑ q 9i´ = ∑( g i ∙ с i· t i) ; g i – масса уносимого газа, кг; с i– удельная теплоемкость уносимого газа, кДж / кг ∙ К /2/; t i– температура уносимого газа, К.
q NO2´ = 13,6 ∙ 0,754 ∙ 358 = 3671,08 кДж
q NO´= 7,09 ∙ 0,996 ∙ 358 = 2528,07 кДж
q N2´ = 15,46 ∙ 1,040 ∙ 358 = 5756,07 кДж
q O2´= 7,26 ∙ 0,923 ∙ 358 = 2398,95 кДж
q НNO3´= 2,48 ∙ 1,800 ∙ 358 = 1598,11 кДж
q Н2O´= 1,45 ∙ 1,873 ∙ 358 = 972,27 кДж
Итого: q 9´ = 16924,55 кДж
Отсюда Q расход = 83309,2 + 163367,77 + 10866,71 + 966416 + 1694,7 + 167898,42 + 16924,55 = 1410477,35 кДж
Приравнивая приход теплоты к расходу, определяем количество теплоты, которое необходимо подать в колонну с перегретым паром.
Q приход = 1455046,74 + 278112,61 + 537186,28 + 142103,97 + 5517,20 + q 6 = 2417966,8 + q 6 = Q расход
2417966,8 + q 6 = 2951575,66
Отсюда q 6 = 533608,86 кДж
Таблица 3.4 – Тепловой баланс концентрирования азотной кислоты
Приход | кДж | Расход | кДж |
1 | 2 | 3 | 4 |
1. Теплота от поступающей серной кислоты с массовой долей 92 %. 2. Теплота, поступающая с азотной кислотой с массовой долей 50 %: 3. Физическая | 1455046,74
278112,61
537186,28 | 1. Теплота закрепления азотной кислоты, находящейся в отработанной кислоте с 29 % до массовой доли 98 % 2. Физическая теплота, уносимая парами кислоты с | 83309,2 163367,77 |
Продолжение таблицы 3.4 | |||
1 | 2 | 3 | 4 |
теплота, поступающая с отработанной кислотной смесью 4. Физическая теплота, поступающая с азотной кислотой с массовой долей 98 %, поступающей из конденсатора в зону отдувки 5. Физическая теплота, поступающая с воздухом, подсасываемым из помещения 6. Физическая теплота, поступающая с перегретым паром
|
142103,97
5517,20
533608,86 | массовой долей 98 % из колонны при 85 ºС 3. Расход теплоты на испарение азотной кислоты 4. Расход теплоты на испарение 2 % воды, содержащейся в азотной кислоте 5. Физическая теплота, уносимая с отработанной серной кислотой с массовой долей 70 % из колонны при 170 ºС 6. Расход теплоты на нагревание подсасываемого воздуха в среднем до 90 ºС |
113847,93
10866,71
2518366,4
1694,7
167898,42 |
Продолжение таблицы 3.4 | |||
1 | 2 | 3 | 4 |
|
| 7. Расход теплоты, уносимой с 98 % азотной кислотой с массовой долей из колонны при температуре 85 ºС 8. Расход теплоты в окружающую среду 9. Теплота, уносимая нитрозными газами |
6072,46
16924,55
|
Итого: | 2951575,66 | Итого: | 2951575,66 |
3.2.2 ТЕПЛОВЫЕ РАСЧЕТЫ ОТДЕЛЕНИЯ КОНЕНТРИРОВАНИЯ СЕРНОЙ КИСЛОТЫ
Исходные данные:
1. Температура продукционной кислоты /3/ с массовой долей 92 %, вытекающей из концентратора t = 240 ºС.
1. С разбавленной серной кислотой 70 % при t = 120 ºС
4. С дымовыми газами, поступившими из топки, t = 900 ºС
5. Температура кислотного конденсата с массовой долей 70 % из брызгоулови-тельной ступени на входе в концентратор t = 130 ºС.
6. Температура брызг серной кислоты 70 %, поступающей на брызгоуловитель-ную ступень, t = 150 ºС.
Общий вид уравнения теплового баланса:
Q приход = Q расход , (кДж) (3.54)
Приход теплоты в концентратор:
1. С серной кислотой с массовой долей 70 %:
q 1 = Gразб ∙ Н, (кДж) (3.55)
где Gразб – масса серной кислоты с массовой долей 70 %, кг; Н – удельная энтальпия кислоты при 120 ºС, кДж/кг.
q 1 = 7650,28∙ 271,7 = 2078581,1 кДж
2. С конденсатом:
q 2 = Gконд ∙ Н, (кДж) (3.56)
где G конд – масса конденсата, поступающего в колонну из конечной брызгоуло-вительной ступени, кг; Н – удельная энтальпия кислоты при 130 ºС, кДж/кг.
q 2 = 5355,2 ∙ 262,1 = 1403597,92 кДж
3. С топочными газами, поступившими из топки:
q 3 = Gтоп газ ∙ с · t , (кДж) (3.57)
где Gтоп газ – масса топочных газов, кг; с – удельная энтальпия газов, кДж/кг · К /2/; t – температура поступивших газов, К.
q 3 = 2600 ∙ 1,450 · 1173 = 4422210 кДж
Общий приход тепла: Qобщ = q 1 + q 2 + q 3 = 2078581,1 + 1403597,92 + 4422210 = 7904389,02 кДж
Расход теплоты в концентраторе:
1. С продукционной кислотой при 250 ºС:
q 1´ = Gконц ∙ Н конц, (кДж) (3.58)
где H конц = 436 кДж/кг – энтальпия серной кислоты 92%; Gконц – масса выходящей из колонны серной кислоты с массовой долей 92 %, кг.
q 1´ = 6043,76 ∙ 436 = 2635079,36 кДж
2. С водяным паром выделяется при выпаривании и разложении:
q 2 ´ = Cвп ∙ Hвп , (кДж) (3.59)
где Gвп = Gуп + Gразл = 1606,56 + 0,42 = 1606,98 кг; Hвп = 2737,7 кДж/кг – энтальпия водяного пара.
q 2 ´ = 1606,98 · 737,7 = 4399429,15 кДж
3. С дымовыми газами, уходящими с t = 130 ºС:
q 3´ = Gтоп газ ∙ с 2 · t 2, (кДж) (3.60)
где Gтоп газ – масса дымовых газов на м 3 сжигаемого газа, кг; с 2 – удельная теплоемкость дымовых газов при t = 130 ºС /2/; t 2 – температура дымовых газов, К.
q 3 ´ = 2600 ∙ 1,336 · 403 = 1399860,8 кДж
4. На испарение серной кислоты:
q 4 ´ = G исп ∙ H исп, (кДж) (3.61)
где Gисп – масса серной кислоты, уносимой дымовыми газами, кг; Н исп = 511.2 кДж/кг – удельная теплота парообразования серной кислоты.
q 4 ´ =2,3 · 511,2 = 1175,76 кДж
5. С парами серной кислоты:
q 5 ´ = G исп ∙ H , (кДж) (3.62)
q 5´ = 2,3 ∙ 201,4 = 463,22 кДж
где Н – энтальпия 100% серной кислоты при температуре отходящих газов 130 ºС
/6/.
6. На разложение серной кислоты:
q 6 ´ = G разл ∙ Q разл / М Н2SО4 , (кДж) (3.63)
q 6 ´ = 2,3 ∙ 228900 / 98 = 5372,14 кДж
Похожие работы
... Содержание прокаленного остатка, в % 0,4 4. Содержание окислов азота N2O3, в %, не более 0,01 5. Содержание железа, в %, не более 0,2 3. Отработанные и вытесненные кислоты представляют собой тройную смесь азотной и серной кислот, а также воды. Таблица №5 - Состав тройных смесей № Наименование составных частей Отработанной кислоты Вытесненной кислоты 1. Азотная ...
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
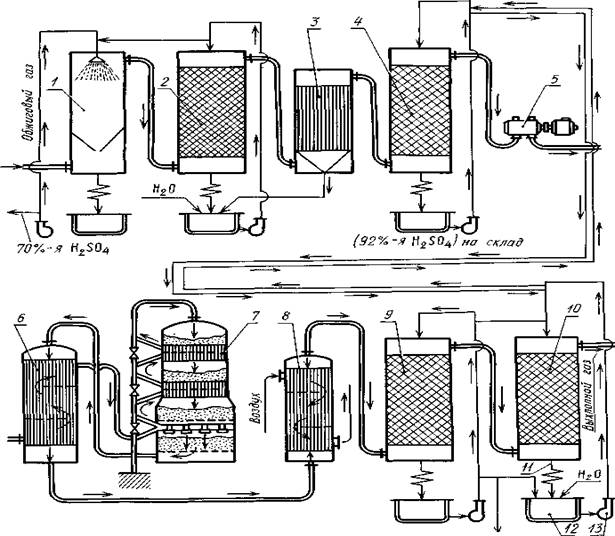
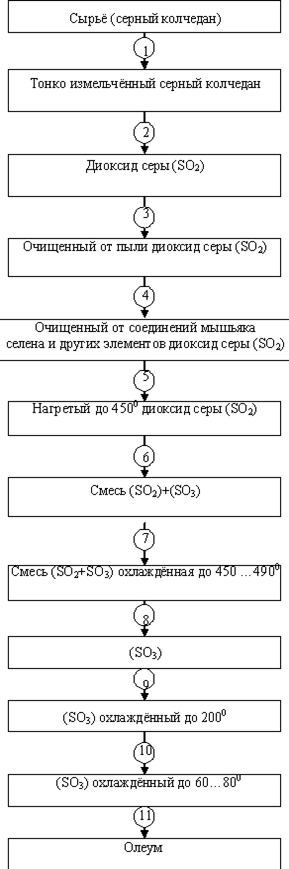
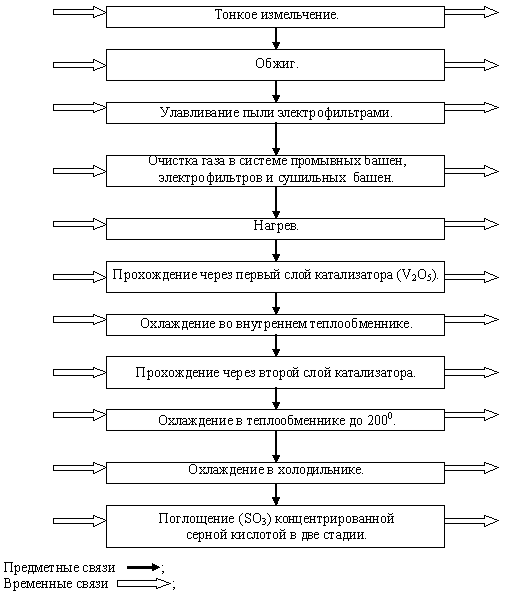
... между трубками теплообменников, расположенных в контактном аппарате между полками с контактной массой, нагревается до 450 °С и поступает на верхний слой катализатора, где 70...75 % Рис. 2.2. Схема производства серной кислоты контактным способом: 1, 2—промывные башни (полая и с насадкой); 3 — электрофильтр; 4 — башня с насадкой; 5 - турбокомпрессор; 6 - теплообменник; 7 — контактный аппарат; ...
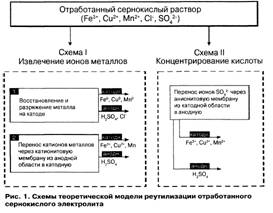
... 300 С ). Недостатком схемы является большой расход щелочи и сложность регенерации ее из шлама [ 3 ]. Глава 2. Обеспечение экологической безопасности путем разработки малоотходного способа реутилизации сернокислых отходов аккумуляторных батарей Экологическая безопасность и эффективное функционирование экономики каждого государства неразрывно связаны с транспортной отраслью. Транспортные ...
0 комментариев