Навигация
Задачи для самостоятельного решения
5.3 Задачи для самостоятельного решения
1. Распад N2O на N2 и О2 идет по схеме N2О ® N2 + О. При облучении светом с длиной волны 180 нм энергия активации Еа не совпадает с энергией термического распада, которая равна 222 кДж/моль. Сравните две величины энергии активации и объясните их расхождение.
2. При облучении НI светом с длиной волны 263 нм газо-образный НI разлагается на I2 и Н2. Энергии диссоциации НI соответствует 24080 Дж/моль. Рассчитайте энергию, которой обладает 1 молекула продукта реакции. При поглощении 22,6 кДж разлагается 0,1 моль НI. Рассчитайте квантовый выход.
3. Рассчитайте длинноволновую границу спектра, где энергия поглощенного кванта света достаточна для диссоциации молекулы хлора. Примите энергию разрыва связи в молекуле хлора равной 242,6 кДж/моль.
4. Смесь водорода и хлора хранится под водой при 10 оС в V = 10 литровом сосуде при Р = 700 мм рт. ст. Найдите квантовый выход реакции образования НС1, если в результате поглощения 103 Дж лучистой энергии с длиной волны 589 нм давление снизилось на 85 мм рт. ст.
5. При фотобромировании коричной кислоты с использованием света с длиной волны 435,8 нм при температуре 30,6 оС интенсивностью 1,4.10-3 Дж/с скорость уменьшения количества Вr2 составляет 0,075 моль в течение 1105 с. Раствор поглощает 80,1% прошедшего через него света. Рассчитать квантовый выход.
6. Предполагается, что механизм фотохимической реакции водорода с парами йода при 480 К следующий:
I2 + hn ® 2 I•k1
2 I• + I2 ® 2 I2k2
2 I• + H2 ® I2 + H2k3
2 I• + H2 ® 2 HIk4
При условии, что k4<< k3 и I – интенсивность поглощенного света, показать, что d[HI] / dτ = 2.I. k4[H2]/k2. [I2]+ k3.[H2]
7. Определите квантовый выход фотохимического синтеза фосгена СО + С12 = СОС12, если количество поглощенной энергии Q = 2.105 Дж, длина волны l = 510 нм, выход фосгена 8,5 кг.
8. Сосуд вместимостью 100 см3, содержащий смесь водорода с хлором, облучен светом с длиной волны l = 400 нм. Скорость поглощения света равна 11,0.10-7 Дж/с. После одной минуты облучения парциальное давление С12 (Р0 = 205 мм рт. ст.) понизилось на 49 мм рт. ст. (проведено при 0 оС). Каков квантовый выход НС1?
9 Аммиак разлагается ультрафиолетовым светом (l=200 нм) с квантовым выходом g = 0,14. Определите количество лучистой энергии, необходимой для разложения 1 г NH3.
6. СЛОЖНЫЕ РЕАКЦИИ
6.1 Необходимые исходные сведения и основные уравнения
Для мономолекулярных обратимых реакций типа А « В дифференциальные формы кинетического уравнения:
![]() ,(6.1)
,(6.1)
![]() .(6.2)
.(6.2)
При равновесии 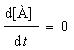 , и если при t = 0 [B] = 0, то
, и если при t = 0 [B] = 0, то
[В]р/[А]р![]() Кр; (6.3)
Кр; (6.3)
[B]р = [А]0 - [А]р;(6.4)
[В]р ![]() [А]0,(6.5)
[А]0,(6.5)
где [А], [B] – текущие концентрации веществ А и В; [А]0 – концентрация А при t = 0; k1 и k2 – константы скорости прямой и обратной реакций; [А]р и [B]р – концентрации А и В при равновесии; Кр– константа равновесия.
Интегральные формы кинетического уравнения:
![]() ;(6.6)
;(6.6)
![]() . (6.6а)
. (6.6а)
При условии, что в момент времени t = 0 [B]0 = 0:
![]() .(6.7)
.(6.7)
Для мономолекулярных параллельных реакций типа
С ¬ А ® В дифференциальные формы кинетического уравнения:
![]() ;(6.8)
;(6.8)
![]() .(6.9)
.(6.9)
Интегральные формы кинетического уравнения:
![]() ; (6.10)
; (6.10)
![]() , (6.11)
, (6.11)
где k1 и k2 – константы скорости первой и второй реакций. Константы скоростей отдельных стадий для реакций данного типа определяют по соотношению:
х1/х2 = k1/k2, (6.12)
где х1 и х2 – количества молей веществ В и С, образовавшихся к моменту времени t или приращение концентраций веществ В и С. Текущая концентрация исходного вещества имеет вид
[А] = [А]0 – х. (6.12а)
Для мономолекулярных последовательных реакций типа
![]() дифференциальные формы кинетического уравнения:
дифференциальные формы кинетического уравнения:
![]() ; (6.13)
; (6.13)
![]() ; (6.14)
; (6.14)
![]() ; (6.15)
; (6.15)
![]() ; (6.16)
; (6.16)
![]() . (6.17)
. (6.17)
Интегральные формы кинетического уравнения:
![]() ; (6.18)
; (6.18)
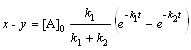 ; (6.19)
; (6.19)
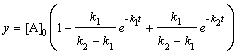 ; (6.20)
; (6.20)
![]() ; (6.21)
; (6.21)
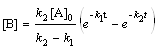 ; (6.22)
; (6.22)
[C] = [А]0 - [А] - [B], (6.23)
где [А], [В], [С] – текущие концентрации веществ А, В, С; [А]0 – концентрация вещества А при t = 0; k1 и k2 – константы скорости первой и второй реакций: [А] = [А]0 – х; [В] = x – y; [C] = y.
Точка максимума на кривой [В] = f(t) характеризуется уравнениями
 ; (6.24)
; (6.24)
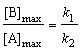 ; (6.25)
; (6.25)
![]() , (6.26)
, (6.26)
где tmax – время соответствующее максимальной концентрации вещества В.
Похожие работы
... параметров ионного и электронного транспорта в переходных слоях интерфазы. 4. Принципы создания твердофазных электрохимических преобразователей энергии и информации. 5. Гипотеза о самоорганизации переходных ион-проводящих структур при протекании электрохимических и химических процессов на фазовых границах. Определяющую роль матричных структур в твердофазных электродных реакциях. ...
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... агрессивных средах и при наличии различных сопутствующих физических факторов; 3. Определить методы применения противокоррозионных защитных покрытий, в первую очередь лакокрасочных. Обзорно-аналитическая часть Характеристика коррозионных процессов Коррозия металлов - разрушение металлов вследствие физико-химического воздействия внешней среды, при этом металл переходит в окисленное (ионное) ...
... не менее пяти циклов разряд – заряд глубиной 250 Кл/см2. Основные результаты и выводы Настоящая работа обобщает результаты комплексного исследования механизма и кинетики электродных процессов в ионной и электронной подсистемах в низкотемпературных твердых электролитах с использованием импульсных методов. Важнейшим результатом работы является получение новых и уточнение полученных другими исс

0 комментариев