Навигация
ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
2. ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
2.1 Необходимые исходные сведения и основные уравнения
ЭДС гальванического элемента Е равна разности условных электродных потенциалов его полуэлементов φ1 и φ2. Если значением диффузионного потенциала можно пренебречь то
Е = φ2 - φ1(2.1)
(индекс 2 относится к более положительному электродному потенциалу). Электрохимические реакции, протекающие на электродах, и сами электроды разделяют на следующие типы:
1. Электроды 1-го рода, обратимые по катиону: Меn+ + ne = = Ме0, где Меn+ и Ме0 ― окисленная и восстановленная формы вещества; nе - количество электронов. Потенциал электрода 1-го рода рассчитывается по уравнению Нернста:
φ = φ0![]() (aOx/aRed),(2.2)
(aOx/aRed),(2.2)
где φ - потенциал электрода, В; φ0 - стандартный потенциал электрода, В; n - число электронов, участвующих в элемен-тарной реакции; F - число Фарадея; aRed и aOx - активности вос-становленной и окисленной форм вещества, вступающего в реакцию. Множитель ![]() при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
а) серебряный электрод:
Ag+│Ag; Ag+ + e = Ag0; n =1;aOx= aAg+; aRed = aAg =1,
φ = φ0Ag+ ![]() lgaAg+; (2.3)
lgaAg+; (2.3)
б) амальгамный электрод:
Cd2+ │[Cd] (Hg)Cd2+ + 2e = [Cd]ам; n = 2; aOx = aCd+
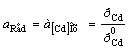 ; φ = φ0AСd2+
; φ = φ0AСd2+ 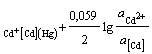 ,(2.4)
,(2.4)
где φ![]() - потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
- потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
в) газовый электрод:
H+ │Pt, H2; H+ + e =½ H2; n = 1; aOx = aH++; aRed = ![]() =
= ![]() ;
;
φ = φ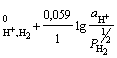 .(2.5)
.(2.5)
2. Электроды 2-го рода, обратимые по аниону, представляют собой металл, покрытый труднорастворимой солью этого метал-ла, который находится в равновесии с раствором, содержащим соответствующий анион: AgCl + e = Ag + Cl-; n=1; aOx = aAgCl = 1; aRed = aCl-;
φ = φ![]() ; (2.6)
; (2.6)
φ02 =φ![]() ,(2.7)
,(2.7)
где j ![]() ― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод:
½ Cl2 + e = Cl-; n = 1; aOx = ![]() ; aRed =
; aRed = ![]() ;
;
φ = φ![]() . (2.8)
. (2.8)
б) каломельный электрод Cl-│Hg2Cl2, на котором идет электродная реакция HgCl2 + 2e = Hg+ + 2Cl- ;
φ![]() φ
φ![]() .
.
в) хлорсеребряный электрод Cl-│AgCl, Ag, на котором идет электродная реакция AgCl + e = Ag+ + Cl-;
φ![]() φ
φ![]() .
.
Окислительно-восстановительные электроды (редокси – электроды) представляют собой инертный металл, опущенный в раствор, содержащий окисленную и восстановленную формы. Уравнение Нернста для данных электродов имеет вид:
φ Red= φ![]() , (2.9)
, (2.9)
где аОх(аО) ― активность окисленного иона; aRed(aВ) - активность восстановленного иона. Они делятся:
а) на простые: Fe3+ + e = Fe2+; n = 1; aRed = ![]() ; aOx =
; aOx = ![]() ;
;
φ = φ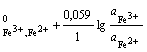 ; (2.10)
; (2.10)
![]() ; n = 1;
; n = 1; ![]() ;
; ![]() ;
;
φ = φ![]() ; (2.11)
; (2.11)
б) на сложные:
![]() ;
;
φ = φ . (2.12)
. (2.12)
Хингидронный электрод: C6H4O2 (хинон) + 2H+ + 2e = = C6H4(OH)2 (гидрохинон);
n = 2, aRed = aгх = 1; аОх = ах= 1;
φ = φ![]() + φ
+ φ![]() . (2.13)
. (2.13)
Связь константы равновесия химической реакции и стандартных электродных потенциалов выражается соотноше-нием
![]() (φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
(φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
Для концентрационных цепей уравнение Нернста (при отсутствии диффузионного потенциала) для электродов типа
Cu | Cu2+ ║ Cu2+ | Cu ; Ag, AgCl | HCl ║ HCl | Ag, AgCl
a1 a2 (a2 > a1) a1 a2 (a2 > a1)
имеет вид
![]() , (2.15)
, (2.15)
где а1 и а2 ─ активности ионов Cu2+ и Cl- соответственно.
Для электродов 2-го рода типа: Pt, H2 (P1) | HCl | Pt, H2 (P2), уравнение (2.15) преобразуется в уравнение
![]() (Р1/Р2), (2.16)
(Р1/Р2), (2.16)
где P1 и P2 - давления водорода, P1 > P2.
Для амальгамного элемента: Hg [Cd] (a1) | Cd2+ | Hg [Cd] (a2), (a2 > a1), уравнение Нернста имеет вид
![]() (а1/а2), (2.17)
(а1/а2), (2.17)
где a1 и a2 ─ активности металлического кадмия в амальгаме. Для элемента типа: Cd(ж) (a1 = 1) | Cd в расплаве солей | Cd в расплаве Cd – Sn (a2) уравнение (2.17) принимает вид
![]() , (2.18)
, (2.18)
где a2 ─ активность кадмия в расплаве Cd – Sn.
Расчет ЭДС концентрационной цепи (например, серебряной, Ag | AgNO3 (а1) ║ AgNO3 (а2) | Ag,) производится по формуле
Е = 2.0,059. l∞,![]() . lg(а1/а2) /(l∞,
. lg(а1/а2) /(l∞,![]() +l∞,
+l∞,![]() ) (2.19)
) (2.19)
где λ∞,Ag+ и λ∞,![]() - подвижности аниона и катиона.
- подвижности аниона и катиона.
Термодинамические функции ΔG, ΔS, ΔH для электрохимических реакций рассчитывают по уравнениям:
ΔG = - nEF, (2.20)
![]() , (2.21)
, (2.21)
![]() , (2.22)
, (2.22)
![]() , (2.23)
, (2.23)
![]() , (2.24)
, (2.24)
где n – число электронов, участвующих в реакции; F – число Фарадея, Кл; E – ЭДС, В.
Похожие работы
... параметров ионного и электронного транспорта в переходных слоях интерфазы. 4. Принципы создания твердофазных электрохимических преобразователей энергии и информации. 5. Гипотеза о самоорганизации переходных ион-проводящих структур при протекании электрохимических и химических процессов на фазовых границах. Определяющую роль матричных структур в твердофазных электродных реакциях. ...
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... агрессивных средах и при наличии различных сопутствующих физических факторов; 3. Определить методы применения противокоррозионных защитных покрытий, в первую очередь лакокрасочных. Обзорно-аналитическая часть Характеристика коррозионных процессов Коррозия металлов - разрушение металлов вследствие физико-химического воздействия внешней среды, при этом металл переходит в окисленное (ионное) ...
... не менее пяти циклов разряд – заряд глубиной 250 Кл/см2. Основные результаты и выводы Настоящая работа обобщает результаты комплексного исследования механизма и кинетики электродных процессов в ионной и электронной подсистемах в низкотемпературных твердых электролитах с использованием импульсных методов. Важнейшим результатом работы является получение новых и уточнение полученных другими исс

0 комментариев