Навигация
Задачи для самостоятельного решения
6.3 Задачи для самостоятельного решения
1. Для обратимой реакции первого порядка![]() Кр=10, а k1 = 0,2 с–1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
Кр=10, а k1 = 0,2 с–1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
2. Превращение роданида аммония NH4SCN в тиомочевину (NH2)2CS ─ обратимая реакция первого порядка. Рассчитайте скорости прямой и обратной реакций, используя следующие экспериментальные данные:
| t, мин | 0 | 19 | 38 | 48 | 60 | ∞ |
| Доля прореагировавшего NH4SCN, % | 2.0 | 6,9 | 10,4 | 12,3 | 13,6 | 23,2 |
3. В параллельных реакциях первого порядка: В ¬ А ® С выход вещества В равен 53%, а время превращения А на 1/3 равно 40 с. Найдите k1 и k2.
4. Реакция разложения вещества А может протекать парал-лельно по трем направлениям:
D ¬ А ® В
î® C.
Концентрации продуктов в смеси через 5 мин после начала реакции составляли, моль/л: [В]=3,2, [С]=1,8, [D]=4,0. Опреде-лите константы скорости k1…k3, если период полураспада ве-щества А равен 10 мин.
5. Реакция разложения вещества А может протекать по трем направлениям:D ¬ А ® В
î® C.
Концентрации продуктов в смеси через 10 мин после начала реакции составляли, моль/л: [В]=1,6, [С]=3,6, [D]=7,8. Опреде-лите константы скорости k1…k3, если период полураспада ве-щества А равен 8 мин.
6. Образец радиоактивного урана массой 100 г распадается по схеме: 239U ® 239Np ® 239Pu. (периоды полураспада – 20 и 600 мин). Рассчитайте массы нептуния и плутония: через 20 мин и 20 суток после начала распада. Определите максимальную массу нептуния, которая может быть получена из данного образца урана.
7. Кинетика обратимой реакции А ↔ В измерена при двух значениях температуры. Получены следующие эксперимен-тальные данные:
1) Т = 293 К
| t. мин | 0 | 10 | 20 | ∞ |
| Доля В в смеси, % | 2,0 | 21,5 | 31,0 | 39,7 |
2) Т = 313 К.
| t. мин | 0 | 3 | 9 | ∞ |
| Доля В в смеси, % | 2,0 | 27,1 | 45,2 | 50,7 |
Рассчитайте; а) энергии активации прямой и обратной реакций; б) константы равновесия при двух значениях температуры; в) тепловой эффект прямой реакции.
8. В системе протекают две параллельные реакции: А + В → → продукты (k1) и А + С → продукты (k2). Отношение k1/k2 = 7. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировало к этому моменту?
9. Константа реакции цис-, трансизомеризации бутена-2 при 417 оС равна 8,52.10-7 с-1, Константа равновесия при этой температуре равна 1,14. В начальный момент времени присутствует только цисизомер. Определите время, за которое прореагирует 30% бутена-2.
10. Константа скорости прямой реакции NH4SCN ↔ ↔ (NH2)2CS при 25 оС равна 7,66.10-7 мин-1. Константа равновесия при этой температуре равна 1,30. В начальный момент времени присутствует только роданид аммония. Определите время, за которое прореагирует 40% исходного вещества.
11. При смешении (273 К) раствор содержал 73,2% этилового спирта, 0,677 моль HCOOH и 0,0261% HCl (вода не учитывается). Для исследования кинетики реакции образования формиата при 521 К отбирали в различное время пробы объемом 5 мл и оттитровывали Ba(OH)2. Результаты титрования представлены в таблице:
| t, мин | 0 | 50 | 100 | 160 | 220 | ∞ |
| V, мл | 43,52 | 40,40 | 37,75 | 35,10 | 31,09 | 24,28 |
Вычислите константы образования k1 и разложения k2 этилформиата в этом растворе и константу равновесия обратимой реакции Кр, если концентрации воды, этанола и ионов водорода постоянны.
12. Образование этилового эфира муравьиной кислоты при 303 К протекает по уравнению реакции первого порядка: HCOOH + C2H6O → HCOOC2H5. Были получены следующие результаты:
| t, мин | 0 | 1700 | 1000 | 14000 | 20000 | 40000 |
| Количество кислоты, см3 | 29,44 | 28,59 | 24,77 | 23,05 | 21,28 | 16,80 |
Концентрацию кислоты определяли титрованием. Константа обратной реакции k1 = 1,5.10-5 мин-1. Концентрация продукта прямой реакции в начальный момент равна 0. Определите константу прямой реакции.
13. Для реакции между иодистым метилом и раствором диметилпаратолуидина в нитробензоле CH3C6H4N(CH3)2+CH3I® ® H4C6H3CN(CH3)3 получены следующие данные:
| t, мин | 10,2 | 26,5 | 36,0 | 78,0 |
| x/c0 | 0,175 | 0,343 | 0,402 | 0,523 |
Константа равновесия реакции равна 69,8. Начальные концентрации обоих реагентов равны 0,05 моль/л, продукт в процессе реакции отводится. Определите, по какому кинетическому уравнению следует описать кинетическую кривую, и рассчитайте константу скорости реакции.
14. Реакция термического крекинга нефти относится к консекутивной реакции, причем бензин является промежуточным продуктом, распадающимся на газообразные вещества. Определите максимальную концентрацию бензина и время ее достижения при крекинге 1 т нефти, если при 673 К константа образования бензина k1 = 0,283 ч-1, а константа распада бензина k2 = 0,102 ч-1.
15. Покажите, что для реакций А ![]() В и А
В и А![]() С время, за которое образуется половина количества В (по сравнению с его количеством при t = ∞) и время, за которое образуется половина количества С, одинаково, хотя константы k1 и k2 имеют разные значения.
С время, за которое образуется половина количества В (по сравнению с его количеством при t = ∞) и время, за которое образуется половина количества С, одинаково, хотя константы k1 и k2 имеют разные значения.
16. Определите периоды полураспада RaB и RaC, связанные генетическим рядом: RaB ![]() RaC
RaC ![]() RaC΄, если существует зависимость изменения концентрации радиоактивных ядер RaB от времени и время, при котором кон- центрации накопленных RaC, RaC΄ будут максимальны, τmax = = 35 мин. (опыт проводили с чистыми ядрами RaB).
RaC΄, если существует зависимость изменения концентрации радиоактивных ядер RaB от времени и время, при котором кон- центрации накопленных RaC, RaC΄ будут максимальны, τmax = = 35 мин. (опыт проводили с чистыми ядрами RaB).
| Число ядер NRaB | 100 | 70 | 50 | 34 | 17 | 5 | 4 | 2,5 |
| τ, мин | 0 | 10 | 20 | 40 | 50 | 80 | 90 | 100 |
Похожие работы
... параметров ионного и электронного транспорта в переходных слоях интерфазы. 4. Принципы создания твердофазных электрохимических преобразователей энергии и информации. 5. Гипотеза о самоорганизации переходных ион-проводящих структур при протекании электрохимических и химических процессов на фазовых границах. Определяющую роль матричных структур в твердофазных электродных реакциях. ...
... устойчивость металлов и сплавов определяется их стойкостью к коррозии в водной среде. Лучшим способом представления термодинамической информации о химической и электрохимической устойчивости металлических систем в водных растворах являются диаграммы рН-потенциал. Впервые такие диаграммы в системе элемент-вода для чистых металлов при температуре 250С были построены Марселем Пурбе и использованы им ...
... агрессивных средах и при наличии различных сопутствующих физических факторов; 3. Определить методы применения противокоррозионных защитных покрытий, в первую очередь лакокрасочных. Обзорно-аналитическая часть Характеристика коррозионных процессов Коррозия металлов - разрушение металлов вследствие физико-химического воздействия внешней среды, при этом металл переходит в окисленное (ионное) ...
... не менее пяти циклов разряд – заряд глубиной 250 Кл/см2. Основные результаты и выводы Настоящая работа обобщает результаты комплексного исследования механизма и кинетики электродных процессов в ионной и электронной подсистемах в низкотемпературных твердых электролитах с использованием импульсных методов. Важнейшим результатом работы является получение новых и уточнение полученных другими исс
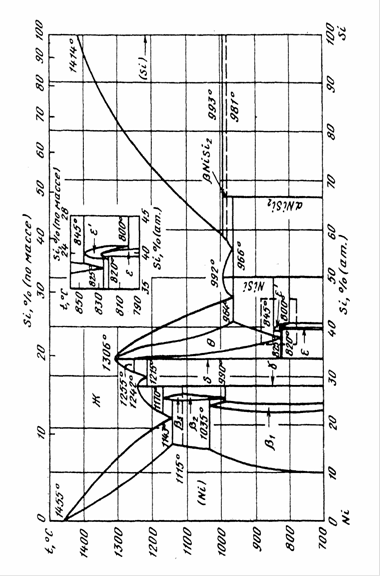

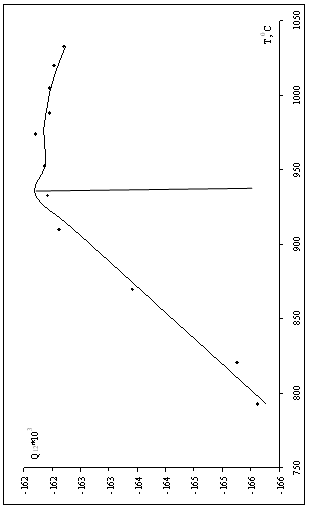
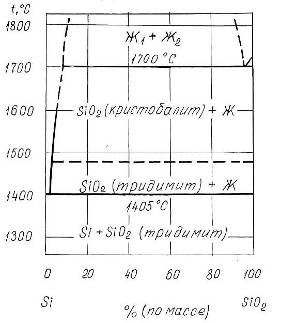
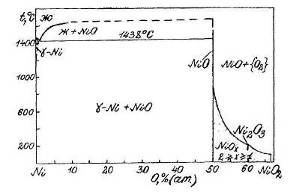
0 комментариев