Навигация
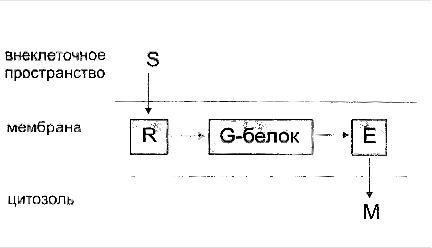
Система фосфолипаза С - инозитол-3-фосфат
1.2 Система фосфолипаза С - инозитол-3-фосфат
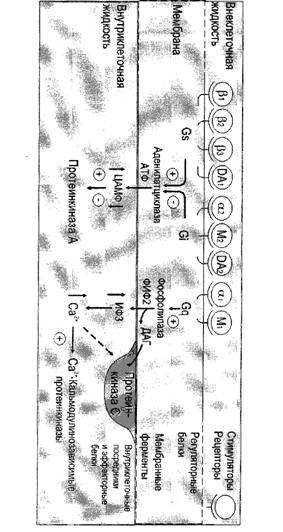
Активация мембранной гуанилатциклазы происходит не под непосредственным влиянием гормон-рецепторного комплекса, а опосредованно через ионизированный кальций и ок-сидантные системы мембран. Определяющая эффекты ацетилхолина стимуляция активности гуанилатциклазы также осуществляется опосредованно через Са2+. Через активацию гуанилатциклазы реализует эффект и на-трийуретический гормон предсердий — атриопептид. Путем активации пе-рекисного окисления стимулирует гуанилатциклазу гормон эндотелия сосудистой стенки оксид азота — расслабляющий эндотелиальный фактор. Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ, активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость фосфорилирования легких цепей миозина в гладких мышцах стенок сосудов, приводя к их расслаблению.
В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ противоположны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращения гладких мышц кишечника цГМФ и подавление цАМФ. цГМФ обеспечивает гиперполяризацию рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный гидролиз цГМФ, а следовательно, и прекращение гормонального эффекта, осуществляется с помощью специфической фосфодиэстеразы.
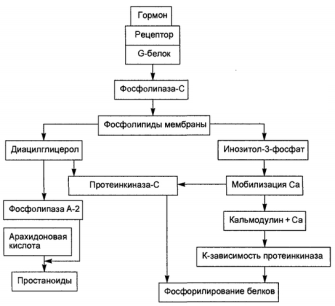
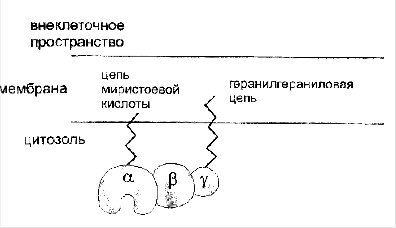
Опосредование гормонального сигнала системой фосфолипаза С—инозитол-3-фосфат.
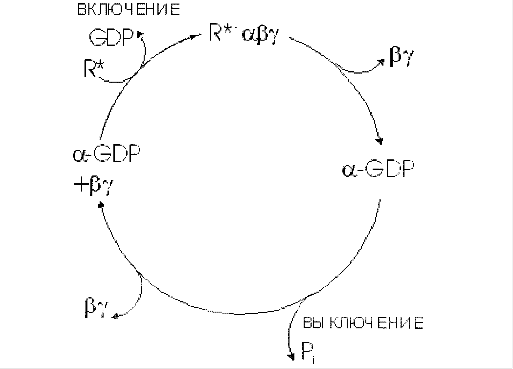
Образование гормон-рецепторного комплекса при участии регуляторного G-белка активирует мембранную фосфолипазу С, вызывающую гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат ведет к выходу Са2+ из внутриклеточных депо. Связывание ионизированного кальция со специализированным белком кальмодулином активирует протеинкиназы и вызывает фосфорили-рование внутриклеточных структурных белков и ферментов. Диацилглицерол повышает сродство протеинкиназы С к Са2+, способствуя ее активации, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует другой путь опосредования гормонального эффекта, активируя фосфолипазу А2 и образование простаноидов.
Гормонрецепторный комплекс с участием регуляторного G-белка ведет к активации мембранного фермента фосфолипазы С, вызывающей гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат вызывает выход Са2+ из внутриклеточных депо, в основном из эндоплазматического ретикулума, ионизированный кальций связывается со специализированным белком кальмодулином, что обеспечивает активацию протеинкиназ и фосфорилирование внутриклеточных структурных белков и ферментов. В свою очередь диацилглицерол способствует резкому повышению сродства протеинкиназы С к ионизированному кальцию, последний без участия кальмоду-лина ее активирует, что также завершается процессами фосфорилирования белков.
Диацилглицерол одновременно реализует и другой путь опосредования гормонального эффекта за счет активирования фосфолипазы А2. Под влиянием последней из мембранных фосфолипидов образуется арахидоновая кислота, являющаяся источником мощных по метаболическим и физиологическим эффектам веществ — простагландинов и лейкотриенов. В разных клетках организма превалирует один или другой путь образования вторичных посредников, что в конечном счете и определяет физиологический эффект гормона. Через рассмотренную систему вторичных посредников реализуются эффекты адреналина (при связи с альфа-адренорецептором), вазопрессина (при связи с V-1-рецептором), ангиотензина-И, соматостатина, окситоцина.
2. Фосфолипазы А2
2.1 Общие сведения (реакция, открытие, строение)
Фосфолипаза А2 (К.Ф.3.1.1.4.) – фермент, катализирующий отщепление остатка жирной кислоты - лецитин, кефалин - от фосфолипидов, превращая их в токсичные соединения, сильно уменьшающие поверхностное натяжение. Эти соединения растворяют эритроциты и другие, клеточные и субклеточные структуры и поэтому его называют лизолецитинами и лизокефалинами
В молекуле фосфолипидов фосфолипаза пчелиного яда отщепляет жирную кислоту со второго места в молекуле и поэтому ее называют фосфолипазой А2. Она известна с 1897 года (Лангер) как фактор, усиливающий гемолитическую активность пчелиного яда после добавления лецитина. Фосфолипаза является наиболее исследованным энзимом пчелиного яда. Как пищеварительный фермент фосфолипаза была открыта в 1900 году. Сейчас очевидно, что фосфолипаза А2 (ФЛА2) – больше чем пищеварительный фермент. Она широко распространена и присутствует в большинстве клеток и тканей млекопитающих, выполняя функции регулятора метаболизма, поддержания мембранного гомеостаза, образования предшественников эйкозаноидов.
В зависимости от молекулярной массы, клеточной локализации и присутствия ионов Са2+ различают цитозольные ФЛА2, секреторные и Са-независимые ФЛА2 или ФЛА2 внешней мембраны.
ФЛА2 включают несколько не связанных белковых семейств с общей ферментативной активностью. Два наиболее важных семейства — это секретируемые и цитозольные фосфолипазы А2.
Цитозольные ФЛА2:
Внутриклеточные фосфолипазы, также как и внеклеточные, относятся к кальций-зависимым ферментам. Структурно, однако, они сильно отличаются от секретируемых фосфолипаз. Как правило, они значительно крупнее (более 700 аминокислот) и содержат C2 домен, который направляет фермент к клеточной мембране. Эти фосфолипазы в основном участвуют в клеточных сигнальных путях, таких как воспалительная реакция. Под действием ФЛА2в клетке может образовываться арахидоновая кислота, предшественник эйкозаноидов, таких активных сигнальных молекул как лейкотриены и простагландины.
ФЛА2 внешней мембраны:
Грам-отрицательные бактерии содержат на внешней мембране ФЛА2 с широким спектром специфичности. В кишечной палочке (Escherichia coli) этот фермент участвует в выбросе токсина бактериоцина из клетки за счёт повышенной проницаемости мембраны при увеличении уровня лизофосфолипидов и жирных кислот в мембране.
Секретируемые ФЛА2:
Экстраклеточные формы фосфолипаз были выделены из различных ядов змей, пчёл и ос. Они также находятся во всех тканях млекопитающих и в бактериях. Активность этих фосфолипаз требует наличия кальция.
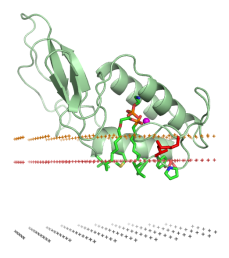
Фосфолипаза А2 пчелиного яда во внеклеточном пространстве вблизи липидного бислоя. Полярные группы фосфолипидов находятся между жёлтой и красной плосткостями. Неполярные ацильные цепи — между красной и чёрной плоскостями.
Панкреатическая фосфолипаза относится к ферментам пищеварения и участвует в переваривании липидов пищи. Фосфолипазы яда участвуют в обездвиживании жертвы за счёт лизиса её клеток.
Похожие работы
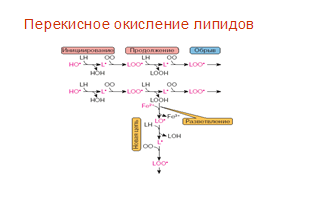
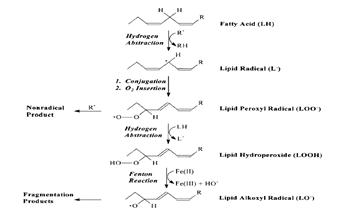
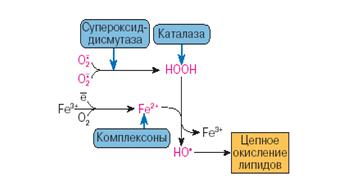
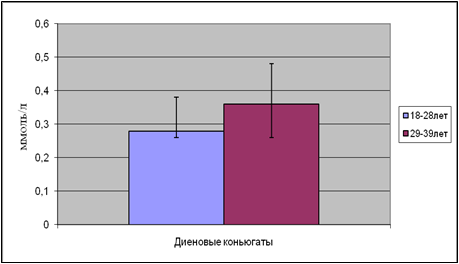
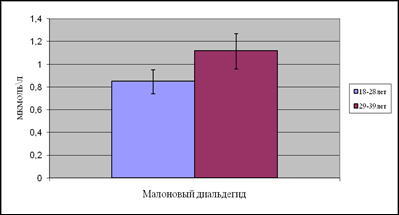
... находится на невысоком уровне, но при стрессовых ситуациях происходит усиленная активация процессов ПОЛ под действием АФК, что приводит к патологическому состоянию. 3.1. Содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин. В данной работе было определено содержание диеновых коньюгатов и малонового диальдегида у небеременных женщин (N=31), которые составили ...
... фосфолипиды. На основе проведенного анализа литературы можно предположить, что диапазон функциональных возможностей мезотелия обусловлен состоянием микроциркуляции. Становится очевидным, что для определения потери антиадгезивных свойств мезотелием брюшины, необходимо изучить морфологические пределы нормального функционирования клеток мезотелия в условиях динамизма микроциркуляциии. Главный ...
... , оранжевыми миндалинами и аккумуляцией эфиров ХС в других ретикулоэндотелиальных тканях. Патология связана с ускоренным катаболизмом апо А-I [8, 2000]. Переваривание и всасывание липидов. Желчь. Значение. На заре формирования современного учения о внешнесекреторной функции печени, когда естествоиспытатели располагали лишь первыми ...
... сигнала по инозитолфосфатному пути. Протеинкиназы Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) ...
0 комментариев