Навигация
2.2 Классификация и свойства
2.2.1 Цитозольные ФЛА2
История цитозольных фосфолипаз группы А2 началась в 1991 г., когда из цитозоля различных клеток животных был выделен и клонирован белок молекулярной массой 85 кДа, который кроме молекулярной массы отличался от известных к тому времени фосфолипаз отсутствием дисульфидных мостиков и чувствительностью к кальцию. Позже скрининг нуклеотидных баз позволил найти ещё два паралога – cPLA2b и cPLA2g. Первый из найденных белков получил название cPLA2a. Называясь «цитозольным», фермент действует тем не менее на мембранах цитоплазматического ретикулума и ядра. Эта изоформа ФЛА2 присутствует во многих клетках и тканях: мозге, почках, селезенке, легких, макрофагах, нейтрофилах, альвеолярных эпителиальных клетках и др. Фермент становится активным в результате фосфорилирования митоген-активируемыми протеинкиназами и протеинкиназой С. Различные внеклеточные цитокины, митогены, гормоны, нейромедиаторы, факторы роста, антигены, эндотоксины, а так же определенные физические и стрессовые воздействия, включая ультрафиолетовый свет и оксидативный стресс, индуцируют активацию и синтез цитозольной ФЛА2.
Основной особенностью этого изотипа фермента является то, что он наиболее активно гидролизует фосфолипидные субстраты, содержащие во втором положении арахидоновую кислоту. Такая субстратная селективность и определяет основную функцию фермента в клетке.
Методом ядерного магнитного резонанса была охарактеризована пространственная структура этого фермента; несколько позже появились рентгеноструктурные данные. Фермент гидролизует сложноэфирную связь в положении sn-2. Для проявления максимальной ферментативной активности требуются сравнительно низкие концентрации ионов Ca2+ (порядка 500 нмоль/л); причём присутствие ионов Ca2+ необходимо не для проявления ферментативной активности, а для связывания белка с поверхностью внутриклеточных мембран или в случае модельных систем – с липидными частицами. Фермент практически не различает группы в положении sn-1, но обладает специфичностью к фосфолипидам, содержащим арахидоновую кислоту в положении sn-2. Олеиновая (18: 1) и линолевая (18: 2) кислоты под действием cPLA2a слабо отщепляются от соответствующих фосфолипидов, но a-линолевая (18: 3) и эйкозапентаеновая (20: 5) кислоты имеют преимущества перед арахидоновой кислотой. Поскольку указанные кислоты находятся в клетках в крайне низких концентрациях, то фосфолипиды с арахидоновой кислотой в положении sn-2 становятся основным субстратом. Фермент не проявляет специфичности к заместителю в положении sn-3, но тем не менее диацилглицерин не является его субстратом. Помимо основной активности фермент проявляет и лизофосфолипазную активность, т. е. способен отщеплять ацил из положения sn-1 лизофосфолипида. Предполагают, что эта активность нужна для защиты клетки от повышенной концентрации лизофосфолипидов, при которой могут нарушаться функции мембран. Показано, что фермент может также проявлять трансацилазную активность. Биологическое значение этой активности изучается.
Паралоги цитозольной ФЛА2 описаны совсем недавно и сведения об их свойствах ограничены. Известно, что белок cPLA2g не содержит кальцийсвязывающего домена и не зависит от ионов Ca2+; имеет всего 29 % сходства с аминокислотной последовательностью белка cPLA2a. Он связан с мембраной за счёт пальмитинового сайта и проявляет в основном изофосфолипазную активность. Показано его участие в развитии апоптоза макрофагов. Белок cPLA2b имеет кальцийсвязывающий домен, но также проявляет преимущественно свойства ФЛА1, т.е. гидролизует связь sn-1.
Фермент cPLA2a – единственная на сегодняшний момент фосфолипаза, которая специфична к арахидоновой кислоте и предпочитает субстраты, локализованные в мембране, а не находящиеся в мономерной форме в растворе. Возможно, эти свойства можно объяснить существованием амфифильной «крышки» (аминокислотные остатки 413-457), которая предотвращает вход жирнокислотного остатка фосфолипида в туннель активного центра в случае, если белок не локализован на мембранах. «Крышка» открывается при взаимодействии белка с анионными липидами мембраны. Межфазный катализ, осуществляемый этим ферментом, интенсивно изучается.
Открытие цитозольной ФЛА2 в конце 1980-х гг. дало толчок к изучению регуляции синтеза эйкозаноидов в организме при остром ответе на различные провоспалительные стимулы. Регуляция секреторной фосфолипазы происходит на уровне её экспрессии, а активность цитозольной фосфолипазы в клетке регулируется также на уровне активности фермента. Основными факторами, влияющими на активность цитозольной фосфолипазы являются концентрация внутриклеточного Са2+ и фосфорилирование этого фермента протеинкиназами. Концентрация ионов Са2+ и активность различных протеинкиназ в клетке являются весьма лабильными параметрами, изменяющимися в течение нескольких секунд после связывания лигандов - агонистов с соответствующими клеточными рецепторами, что позволяет эффективно регулировать в клетке продукцию арахидоновой кислоты и соответственно синтез эйкозаноидов.
В неактивированных клетках концентрация внутриклеточного Са2+ обычно колеблется в пределах 30-100 нмоль/л. При активации различных рецепторов концентрация ионов Са2+ может достигать 1-3 мкмоль/л. В ряде работ было показано, что увеличение активности цитозольной ФЛА2 происходит в диапазоне концентраций ионов Са2+ 150-800 нмоль/л. При увеличении концентрации ионов Са2+ происходит миграция фосфолипазы к мембранам и её прикрепление к ним, после чего начинается гидролиз фосфолипидов.
Связывание фосфолипазы с мембраной происходит за счёт имеющегося в белке домена С2:
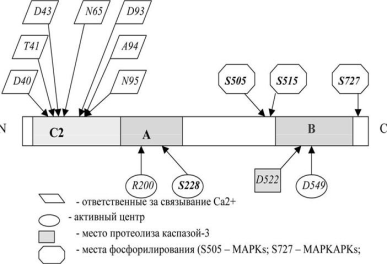
Домен С2 гомологичен подобным доменам протеинкиназы С, ГТФазы, и фосфолипазы С. Все эти белки связываются с мембранами в присутствии ионов Са2+. Наличие достаточных концентраций ионов Са2+ необходимо для ориентации фосфолипазы и её прикрепления. В отсутствие ионов Са2+ фермент сохраняет активность по отношению к растворимым субстратам, таким как 1-пальмитил-2-лизофосфатидилхолин.
В зависимости от типа агониста концентрация ионов Са2+ в клетке меняется по-разному. Одни агонисты вызывают её кратковременный рост внутри клетки; под действием этих агонистов концентрация ионов Са2+ после резкого подъёма возвращается к исходному уровню в течение 1-2 мин. Другие же вызывают продолжительный рост концентрации ионов Са2+, и повышенная концентрация ионов Са2+ сохраняется в клетке от 5-30 мин. На эпителиальных клетках было показано, что для устойчивого прикрепления ФЛА2 к поверхности биологических мембран необходима повышенная концентрация ионов Са2+ в течение 5 мин, а при кратковременном подъёме через 1-2 мин происходит обратная диссоциация белка в цитозоль без заметного высвобождения арахидоновой кислоты. Если же повышенная концентрация ионов Са2+ сохраняется в течение 5 мин и более, то цитозольная фосфолипаза ФЛА2 остаётся на мембране и гидролиз фосфолипидов продолжается даже после возврата концентрации внутриклеточного Са2+ к нормальным значениям.
Для проявления максимальной активности фосфолипазы при кратковременном увеличении концентрации ионов Са2+ внутри клетки необходимо также фосфорилирование белка киназами. В опытах in vitro было показано, что цитозольная фосфолипаза может быть фосфорилирована протеинкиназой С, митогенактивируемыми протеинкиназами р42/р44 или протеинкиназой А, но только фосфорилирование митогенактивируемыми протеинкиназами (MAPK) приводит к значительному увеличению активности фосфолипазы. Митогенактивируемые протеинкиназы фосфорилируют фосфолипазу по остатку Ser-505. В ряде случаев именно фосфорилирование определяет проявление активности фосфолипазы в клетке.
Таким образом, цитозольная фосфолипаза принимает участие как в регуляции синтеза эйкозаноидов при остром ответе клеток на различные провоспалительные стимулы, так и в ряде случаев при отложенном ответе. Основными факторами, регулирующими активность цитозольной фосфолипазы, являются концентрация внутриклеточного Са2+ и активность митогенактивируемых протеинкиназ. Активность фермента может значительно возрастать в течение первых минут после стимуляции клеток. Транслокация фермента при активации важна по двум причинам: 1) позволяет ферменту взаимодействовать с фосфолипидами мембраны; 2) доставляет селективную по арахидоновой кислоте липазу к месту расположения ферментов синтеза простагландинов (PG) и лейкотриенов (LT), т. е. потенциально возможно образование компартмента, в котором высвобождаемая арахидоновая кислота непосредственно метаболизируется далее.
Похожие работы
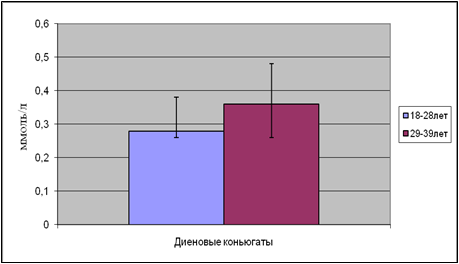
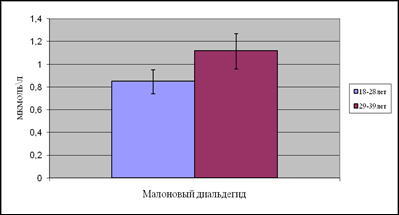
... находится на невысоком уровне, но при стрессовых ситуациях происходит усиленная активация процессов ПОЛ под действием АФК, что приводит к патологическому состоянию. 3.1. Содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин. В данной работе было определено содержание диеновых коньюгатов и малонового диальдегида у небеременных женщин (N=31), которые составили ...
... фосфолипиды. На основе проведенного анализа литературы можно предположить, что диапазон функциональных возможностей мезотелия обусловлен состоянием микроциркуляции. Становится очевидным, что для определения потери антиадгезивных свойств мезотелием брюшины, необходимо изучить морфологические пределы нормального функционирования клеток мезотелия в условиях динамизма микроциркуляциии. Главный ...
... , оранжевыми миндалинами и аккумуляцией эфиров ХС в других ретикулоэндотелиальных тканях. Патология связана с ускоренным катаболизмом апо А-I [8, 2000]. Переваривание и всасывание липидов. Желчь. Значение. На заре формирования современного учения о внешнесекреторной функции печени, когда естествоиспытатели располагали лишь первыми ...
... сигнала по инозитолфосфатному пути. Протеинкиназы Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) ...
0 комментариев