Навигация
2.4 Ингибиторы ФЛА2
2.4.1 Неконкурентные ингибиторы
Снижение каталитической активности ФЛА2 может происходить вследствие нарушения равновесия на одной или на нескольких стадиях ферментативной реакции, поэтому известные ингибиторы этого фермента можно условно разделить следующим образом.
а) Связывание ингибитором фермента (Е) может сдвигать равновесие Е↔Е* влево и понижать концентрацию каталитически активного Е*. Это происходит при добавлении к везикулам субстрата везикул негидролизуемого аналога субстрата, с которым фермент связывается, но не может быстро десорбироваться. Необходимость наличия ионов кальция при связывании ФЛА2 с межфазной поверхностью дает основания относить к числу ингибиторов хелатирующие агенты, например EDTA.
б) Липофилъные соединения изменяют фазовые свойства субстратов и уменьшают плотность заряда на межфазной поверхности, сдвигая равновесие Е↔Е* влево. Было показано, что такие изменения вызывают органические растворители, детергенты, спирты, а также катионные амфифилы, фенотиазины и местные анестетики различной химической природы. Другие ингибиторы - жирные кислоты, мепакрин, аристолоховая кислота - также влияют на стадию связывания-десорбции Е↔Е*, не затрагивая каталитического действия фермента на межфазной поверхности.
в) Некоторые типы неспецифического ингибирования. При определенных условиях скорость гидролиза под действием ФЛА2 фосфолипидов, подвергшихся перекисному окислению, значительно увеличивается. Поэтому антиоксиданты считаются потенциально способными понижать активность фермента. Белки типа липокортина и калпактина солюбилизируют фосфолипиды межфазной поверхности, тем самым снижая активность ФЛА2. Водорастворимые анионы, такие как гепарин, ингибируют связывание ФЛА2с межфазной поверхностью путем блокирования анионного участка связывания фермента.
г) Ковалентные модификации аминокислотных остатков ФЛА2. 1-Бромоктан-2- он и n-бромфенацилбромид ковалентно связываются с His-48 в каталитическом центре фермента и полностью угнетают каталитическую активность; скорость такой модификации значительно снижается, когда фермент уже связан с межфазной поверхностью. Диальдегиды, подобные госсиполу, модифицируют аминогруппы остатков лизина ФЛА2, ответственные за ее межфазное связывание; скорость модификации увеличивается в случае уже связанного с межфазной поверхностью фермента. Подобным образом действуют нестероидный терпеноид маноалид, выделенный из морской губки и его синтетический аналог маноалог.
д) Другие соединения. Предположительно, многие другие соединения, в том числе некоторые лекарства, подавляют активность ФЛА2 in vivo, однако, механизм их ингибиторного действия еще не выяснен. Среди таких веществ - биофлавоноиды и ретиноиды, гидроксиэйкозатетраеновые кислоты, фенофетол (агонист [β-адренэргических рецепторов), габексатмезилат, нисерголин, папаверин, циннаризин и амперон.
2.4.2 Конкурентные ингибиторы
Конкурентные ингибиторы ФЛА2 - это аналоги субстратов, продуктов реакции или комплекса переходного состояния. Они конкурируют с субстратом за связывание с активным центром молекулы Е*, эффективно понижая концентрацию комплекса ES*. Этот механизм ингибирования был экспериментально подтвержден при изучении катализа фосфолипидов под действием ФЛА2 по типу "scooting".
Общепринятая стратегия создания ингибиторов состоит в замене чувствительной к ФЛА2 сложноэфирной связи на негидролизуемую группу. При этом ингибитор должен оставаться близким структурным аналогом субстрата и не вызывать изменений в липидных мембранах. В настоящий момент не представляется возможным сопоставить имеющиеся данные о конкурентных ингибиторах, поскольку еще не выработано единой теории и количественного описания липолиза на границе раздела фаз липид/вода.
Аминоацильные фосфолипиды. Среди фосфатидилхолинов с модификацией.sn-2-сложноэфирной связи был открыт класс мощных конкурентных ингибиторов ФЛА2 - sn-2-амидных аналогов. Замена sn -2-сложноэфирной связи на простую эфирную связь или на углеводородный остаток также приводила к ингибированию ФЛА2 по конкурентному типу, но в меньшей степени.
Влияние аминоацильных аналогов фосфолипидов на ферментативную активность ФЛА2, исследовалось, в основном, в модельных экспериментах со смешанными мицеллами при соблюдении следующих условий:
1)общая концентрация липидов (ингибитора и субстрата) [I] + [S] должна быть постоянной для расчета мольной доли ингибитора, α = [I]/([I] + [S]);
2)молекулы субстрата и ингибитора должны занимать одинаковую площадь на межфазной поверхности;
3)межфазная поверхность мицелл должна быть достаточно большой, чтобы фермент находился только в связанной форме.
Для оценки воздействия ингибитора на активность ФЛА2 была использована условная величина ингибиторной силы (Z), которая является мерой соотношения констант межфазной диссоциации для субстрата и ингибитора и определяется выражением:
Rv = I + αZ,
где Rv - отношение скорости реакции при К≠Кm к скорости реакции при Кi = Кm, α - мольная доля ингибитора в мицелле.
Изучали также ингибиторное действие (R)-1- алкил-2-ациламино-1,2-дидезоксиглицеро-З-фосфохолиновых аналогов на панкреатические фосфолипазы млекопитающих. Среди ингибиторов с насыщенными жирнокислотными цепями наибольшую активность имели аналоги с С10-ацильными цепями. Поведение ненасыщенных аналогов было более сложным как в цвиттерионных, так и в анионных ингибиторах, увеличение числа цис-двойных связей при их определенном расположении в ацильной цепи приводило к возрастанию параметра Z [80].
В ходе исследований стиоамидными аналогами субстратов выяснилось, что тиоамидный аналог фосфатидилэтаноламина с lС50=4.5 * 10-7 М является самым сильным из известных ингибиторов ФЛА2.
Исследования, проведенные с аминоацильными ингибиторами, выявили некоторые аспекты взаимодействия фермент/липид:
1) Введение амидного остатка в sn-2-положение фосфолипида значительно увеличивает его связывание с каталитическим центром ФЛА2: более нуклеофильный атом кислорода амидной группы способен сильнее взаимодействовать с электрофилом этого центра (предположительно, Са2+). Амидная группа предоставляет лучшие возможности и для водородного связывания.
2) α-Метиленовая группа ацильного остатка sn-2-положении фосфолипида отвечает за связывание фосфолипида с каталитическим центром фермента.
3) Увеличение гидрофобности функциональной группы sn-1-положении фосфолипида повышает сродство между ферментом и субстратом.
4) Фосфатидилэтаноламииы оказались более сильными ингибиторами, чем фосфатидилхолины.
Подход к синтезу оптически активных 1-ацил- 2-ациламино-2-дезоксиглицерофосфохолинов основывается на сохранении хиральности исходного соединения (L-серина) на протяжении всего синтеза. Выбранная последовательность введения заместителей предполагает использование минимального числа защитных групп. Также разработан стереоспецифический метод синтеза 1-алкил-2-ациламино-2-дезоксиглицерофосфохолинов исходя из L-серина. Введение алифатической алкильной группы осуществляют взаимодействием метансульфоната жирной кислоты с оксазолинзащищенным дезоксиглицеридом. Рацемические длинноцепочечные ациламиноаналоги фосфолипидов предложено получать исходя из 2-аминопропанола. Описан синтез оптически активного тиоамидного аналога фосфатидилхолина.
Фтаркетоновые аналоги. Ранее установлено, что аналоги субстратов, содержащие поляризованные кетоновые группы, включая фторкетоновые и 1,2-дикетоновые, ингибируют гидролитические ферменты. Наилучшим ингибитором оказался замещенный фосфоэтаноламин с единственным ацильным остатком, несмотря на то, что фермент предпочитает субстраты с двумя ацильными остатками
Так как дифторкетоновая группа легко гидратируется в водном растворе, ингибиторы напоминают по структуре тетраэдрический интермедиат, который образуется во время липолиза.
Среди фторкетоновых аналогов были найдены селективные ингибиторы внутриклеточных цитозольных ФЛА2. Такими ингибиторами оказались электрофильные кетоновые аналоги арахидоновой кислоты.
Самым мощным ингибитором оказался, α-трифторметилкетон арахидоновой кислоты. Методами l9F- и 13С-ЯМР-спектроскопии анализировали строение комплекса этого вещества с ФЛА2. Результаты подтвердили гипотезу о том, что при связывании с активным центром фермента образует полукеталь с остатком серина или треонина молекулы белка, благодаря способности α-фторкетонов легко гидратироваться в водных растворах.
Фосфатные аналоги. Для изучения природы ингибирования ФЛА2 из различных источников и влияния заместителей на ингибиторную способность было синтезировано более 100 sn-2-фосфатных аналогов фосфатидилхолинов. Соединения данного класса ингибировали только фермент, уже связанный с межфазной поверхностью и не оказывали влияния на десорбцию фермента. Фосфатные ингибиторы связываются с активным центром фермента через ион кальция координационной связью Е-Са....О=Р, конкурируя с субстратами. Это взаимодействие модулируется заместителями молекулы ингибитора. Замещение в этом комплексе атома О на S, NН2, группы 0=Р на О=С-О, присутствие отрицательно заряженной фосфатной группы значительно понижало сродство к ферменту. Ингибиторная способность фосфоэфиров находилась в строгой зависимости от стереохимических и структурных особенностей: хиральности sn-2-положения, длины алкильной цепи в sn-положении и присутствия гидрофобного заместителя в sn -3-положении глицерина. Сульфонатные, амидные, оксимсодер жащие, дианионные фосфомоноэфирные аналоги не проявляли ингибиторных свойств.
Алкильные фосфотидилхолины. Для фармакологического использования, по-видимому, наиболее перспективными являются вещества, способные ингибировать ФЛА2 без нарушения структурной организации мембраны. Особый интерес в этом плане представляют липиды с простой эфирной связью. В молекулах липидов данного класса гидрофобные заместители присоединены к гидрофильному остатку за счет негидролизуемой ФЛА2 простой эфирной связи. Вместе с тем, по своему поведению в составе мембран липиды с простой эфирной связью практически не отличаются от своих диацильных аналогов. Изучали влияние длинноцепочечных фосфатидилхолинов с простой эфирной связью на разрушение мембран под действием ФЛА2 методом спектроскопии ''Р-ЯМР и оценивали возможность применения липидов при местных воспалительных реакциях.
Для исследуемых ингибиторов были получены практически одинаковые результаты: введение соединений в состав липидного бислоя из яичного фосфатидилхолина в мольном соотношении 1: 1 приводило к настолько эффективной стабилизации мембран, что не наблюдалось никаких структурных перестроек под действием этого фермента.
Среди фосфолипидов данного класса были найдены ингибиторы цитозольных ФЛА2:, обладающие противовоспалительными и антиаллергическими свойствами.
Похожие работы
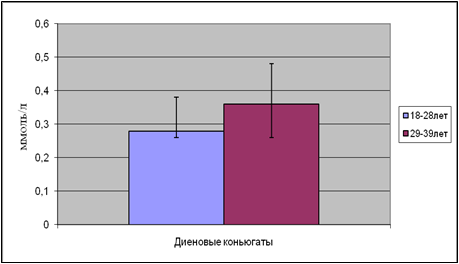
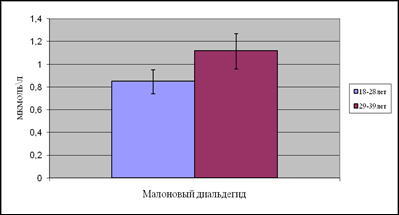
... находится на невысоком уровне, но при стрессовых ситуациях происходит усиленная активация процессов ПОЛ под действием АФК, что приводит к патологическому состоянию. 3.1. Содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин. В данной работе было определено содержание диеновых коньюгатов и малонового диальдегида у небеременных женщин (N=31), которые составили ...
... фосфолипиды. На основе проведенного анализа литературы можно предположить, что диапазон функциональных возможностей мезотелия обусловлен состоянием микроциркуляции. Становится очевидным, что для определения потери антиадгезивных свойств мезотелием брюшины, необходимо изучить морфологические пределы нормального функционирования клеток мезотелия в условиях динамизма микроциркуляциии. Главный ...
... , оранжевыми миндалинами и аккумуляцией эфиров ХС в других ретикулоэндотелиальных тканях. Патология связана с ускоренным катаболизмом апо А-I [8, 2000]. Переваривание и всасывание липидов. Желчь. Значение. На заре формирования современного учения о внешнесекреторной функции печени, когда естествоиспытатели располагали лишь первыми ...
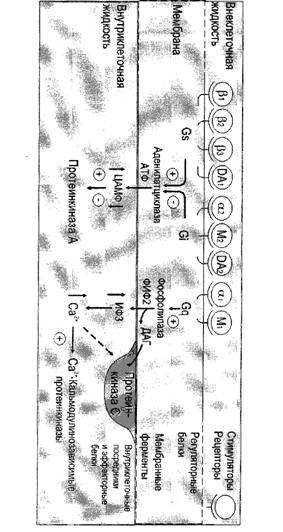
... сигнала по инозитолфосфатному пути. Протеинкиназы Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) ...
0 комментариев