Навигация
Экстенсивные, интенсивные свойства; парциальные величины
1.1.4 Экстенсивные, интенсивные свойства; парциальные величины.
Э
(16)
кстенсивными называют свойства, которые зависят от количества вещества : V, H, S, G и т.д. Для определения экстенсивного свойства g раствора необходимо просуммировать интенсивные (парциальные мольные) характеристики компонентов , умноженные на соответствующие числа молей ni. Например, для энтальпии раствора имеем , или для 1 моля раствора: .Интенсивные свойства раствора – свойства, не зависящие от количества вещества, такие, например, как температура, давление. К числу интенсивных принадлежат и парциальные мольные характеристики . Интенсивные свойства представляют собой частные производные от соответствующих экстенсивных свойств раствора по числу молей данного компонента при постоянных температуре, давлении и числах молей других компонентов:
(17)
.Таким образом, представляет собой приращение свойства бесконечно большого количества раствора при добавлении 1 моля i-того компонента. Например, парциальный мольный объём компонента в растворе заданного состава показывает, на какую величину изменится объём этого раствора (взятого в бесконечно большом количестве) при добавлении 1 моля данного компонента. [6]
1.2 Растворы
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в известных пределах может непрерывно изменяться.
Однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам постоянства состава и кратных отношений.
1.2.1 Идеальные растворы
Цель термодинамической теории расплавов состоит в том, чтобы связать различные свойства растворов и найти способы предсказания свойств растворов, исходя из свойств чистых компонентов. Ввиду очень сложного характера взаимодействия компонентов в растворах решение этой задачи в общем виде невозможно. Поэтому целесообразно сначала рассмотреть идеализированные случаи, в которых можно отделить главные черты явления от второстепенных. [1]
Раствор называется идеальным, если :
а) теплота смешения равна нулю ,
б) изменение объема при смешении чистых компонентов равно нулю
,
в) парциальное давление пара каждого компонента пропорционально его молярной доле. Это означает, при всех концентрациях соблюдается закон Рауля при условии, что пары следуют законам идеальных газов и, следовательно, парциальные давления равны летучим. [7]
Идеальным называется раствор, в котором соблюдается закон Рауля при температурах и давлениях, при которых возможно его существование. Закон Рауля гласит, что для ограниченного числа растворов парциальное давление каждого компонента pi равно произведению молярной доли компонента xi на упругость пара в его чистом виде (давление пара чистого компонента): [2]
(18)
Теплота образования идеального раствора. Поскольку, суммарная энергия взаимодействия частиц при образовании идеального раствора из чистых компонентов не изменяется (такие растворы называют совершенными), парциальные объемы компонентов и их парциальные энтальпии будут равны соответствующим мольным характеристикам: . [6] Таким образом, теплота испарения компонента в идеальном растворе равна теплоте испарения его в чистом виде. [2] В этом случае энтальпия раствора аддитивно складываются из мольных величин:
(19)
где Нидеальн - энтальпия 1 моля идеального раствора;
- энтальпия всех компонентов раствора до смешения.
Из этого следует, что энтальпия, или теплота смешения для идеального раствора , равна нулю, т.е. [2]
(20)
.Изменение объема при образовании идеального раствора. Можно показать таким же образом, как это было сделано выше, что изменение объема при образовании идеального раствора по отношению к аддитивному равно нулю.
Как было сказано ранее, , т.е. парциальный объем компонента идеального раствора равен молярному объему чистого компонента. Подставляя значение для каждого компонента в уравнение аддитивного сложения характеристик раствора, получим:
(21)
где Vидеальн - объем 1 моля идеального раствора;
- объем всех компонентов раствора до смешения.
1.2.1.1 Совершенные растворы.
Как уже говорилось, идеальный совершенный раствор представляет такую модель, в которой закон Рауля выполняется с абсолютной точностью во всем интервале составов. Суммарная энергия взаимодействия частиц при образовании такого раствора из чистых компонентов не изменяется. [6] Такие растворы характеризуется благодаря близости свойств компонентов тем, что они образуются без теплового эффекта и без изменения объема. [1]
Фактором, который вызывает самопроизвольное образование совершенного раствора из чистых компонентов, является изменение энтропии. Оно обусловлено тем, что термодинамическая вероятность раствора (в котором каждая из молекул может находиться в любой части занимаемого им объема) выше, чем вероятность системы, где каждый из компонентов занимает только свой объем, составляющий лишь часть общего объема. Никакого дополнительного изменения энтропии, связанного с упорядочением хаотичного движением молекул, при образовании совершенного раствора не происходит. [6]
Таким образом, в отличие от величин H и V свободная энергия и энтропия при образовании совершенного раствора неаддитивны. Очевидно, энтропия раствора определяется уравнением: [1]
(22)
О
(23)
пределение энтропии образования совершенного раствора с использованием формул молекулярной статистики дает следующие выражения:(24)
.Отсюда следует:
(25)
(26)
(27)
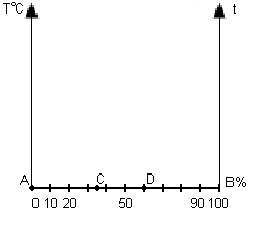
где - химический потенциал компонента в стандартном состоянии (при xi=1). Из приведенных выражений (с учетом xiхарактеризуется симметричной кривой (см. рисунок 1) с максимумом в точке х1=х2=0,5 , для которой =5,77 Дж/(моль*К).
Под активностью компонента в растворе понимают отношение давления насыщенного пара компонента над раствором к аналогичной величине для компонента в стандартном состоянии:
(28)
,где ai – активность компонента i в растворе;
Pi – давление насыщенного пара компонента i над раствором;
- давление насыщенного пара компонента в стандартном состоянии.
В бинарном растворе 1-2 (рисунок 1) активность компонента 2 при его молярной доле х2:
(29)
,где Р2 – давление насыщенного пара компонента 2 над раствором с концентрацией 2, равной х2;
- давление насыщенного пара компонента 2 над чистым веществом 2 при той же температуре.
Из закона Рауля при той же концентрации х2 (см. рисунок 1) имеем:
(30)
,где - давление насыщенного пара компонента 2, полученное расчетом по закону Рауля для концентрации х2.
Для количественной оценки отклонения от закона Рауля вводится коэффициент активности , который устанавливает связь между активностью и концентрацией:
(31)
.И
(32)
з рисунка 1 следует также, чтоДля идеальных растворов и . В случае отрицательных отклонений от закона Рауля . При положительных отклонений от закона Рауля . [6]
Похожие работы
... впервые получены следующие результаты: · Разработана обобщенная координационно-кластерная модель для описания взаимодействий и расчета термодинамических характеристик раствора неметалла в расплаве из трех металлических компонентов. · Установлена связь между термодинамическими свойствами (коэффициентами термодинамической активности и параметрами взаимодействия компонентов первого порядка) и ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... молибдена и др. Эти материалы могут быть использованы в качестве легирующие компоненты для выплавки легированных чугуну и стали. Результаты исследований [11] показали, что использование отработанных никелевых катализаторов позволяет получать заготовку шихты с содержанием никеля 11 % и ванадию 3 % при одношлаковом режиме плавки. 1.2 Особенности редкофазной обновительной плавки. Выполненный ...
... Роквеллу НR Число твердости по Бринеллю НВ, кгс/мм2 Лабораторная работа № 3 Методы исследования качества, структуры и свойств металлов и сплавов Цель работы 1. Изучить сущность, возможности и методику выполнения основных видов макроструктурного и микроструктурного ...



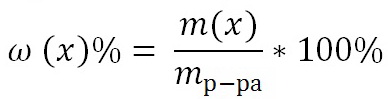
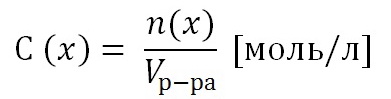



0 комментариев