Навигация
Литературный обзор
1. Литературный обзор
Развитие химической промышленности за последние несколько десятилетий характеризуется увеличением производства продуктов органического синтеза. В настоящее время четыре углеводорода определяют в основном технический прогресс нефтехимической промышленности: этилен, пропилен, бутадиен, и бензол. Основным источником их производства служит процесс термического пиролиза углеводородов.
Первые установки термического пиролиза в трубчатых печах, специально предназначенные для производства низших олефинов, были сооружены в США в 30-х гг.; в странах Западной Европы, Японии и России они появились в 40-50-х гг.
В нашей стране накоплен значительный опыт в области эксплуатации отечественных и зарубежных установок, разработки и освоения новых технических решений по системах пиролиза углеводородов.
В последние 20 лет наибольшее распространение в мировой нефтехимии получил процесс термического пиролиза прямогонного бензина с водяным паром в трубчатых печах, достигший практически предельных выходов целевой продукции. Этому способствовало непрерывное совершенствование основных узлов технологических схем развивающегося производства этилена. Главными целями производителей олефинов есть оптимизация капитальных вложений, обеспечение гибкости по продуктам и сырью, проведение процесса в более жёстких (по температуре и времени пребывания) условиях.
1.1 Кинетика и катализ
1.1.1 Теоретические основы термического пиролиза
Термическое разложение углеводородов представляет собой сложный процесс, который можно представить как ряд протекающих последовательно и параллельно химических реакций с образованием большого числа продуктов. Энергетические характеристики реакций, выражаемые термодинамическими соотношениями, определяют направления и максимальную равновесную степень превращения по ним исходных веществ. Равновесную степень превращения по химической реакции можно вычислить из уравнения зависимости константы равновесия Кр от изменения стандартной энергии Гиббса (свободной энергии, Gо):
![]() .
.
Степень превращения исходных веществ по реакции является однозначной функцией константы равновесия Кр, аналитическое выражение которой определяется стехиометрией реакции.
В результате термического разложения углеводородов получаются различные продукты и в том числе низшие олефины, метан, а также другие алканы меньшей молекулярной массы, чем исходный. Так, при описании пиролиза этана молекулярными реакциями основной является реакция дегидрирования с образованием этилена. При пиролизе пропана наряду с дегидрированием до пропилена происходит расщепление до этилена и метана [1].
Аналогично реакциям дегидрирования и расщепления по двум направлениям можно представить разложение н-бутана. Алканы С2-С4 разлагаются согласно молекулярным реакциям [1]:
![]() (1.1)
(1.1)
![]() (1.2)
(1.2)
![]() (1.3)
(1.3)
![]() (1.4)
(1.4)
![]() (1.5)
(1.5)
![]() (1.6)
(1.6)
Согласно расчетам [1], равновесное дегидрирование алканов С3-С4 может пройти до конца при температуре 800-850оС, а дегидрирование этана – лишь при 900-950оС. Реакции расщепления алканов могут завершаться при более низкой температуре, порядка 250-450оС (Рисунок 1.1), причем, чем больше атомов С в молекуле исходного углеводорода, тем более низкой температуре соответствует его полное равновесное расщепление [1].
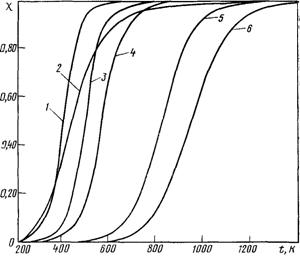
Рисунок 1.1 - Температурная зависимость равновесной степени превращения c алканов С3 - С4 по реакциям дегидрирования и расщепления
(Номера кривых 1, 2, 3, 4, 5, 6 соответствуют номерам реакций в тексте 1.1, 1.2, 1.3, 1.4, 1.5, 1.6)Одной из реакций пиролиза алканов является разложение их на С и Н. С повышением температуры равновесная степень разложения алканов и олефинов по этой реакции возрастает, а ацетилена падает. Поэтому при температуре 1400оС ацетилен становится термодинамически более стойким, чем этилен. Стабильность углеводородов к разложению по этому направлению уменьшается с увеличением числа атомов углерода в молекуле. Практически в условиях пиролиза, т.е. при малом времени пребывания сырья в зоне реакции, распад алканов и олефинов на С и Н, несмотря на его большую равновесную вероятность, осуществляется из-за кинетических ограничений в небольшой степени [1].
Важнейший параметр процесса – температура – определяет степень превращения исходных веществ по реакциям, протекающим при пиролизе, так и распределение продуктов пиролиза. С увеличением температуре в результате первичной реакции повышаются выходы низших олефинов, метана и водорода и снижается выход алканов.
В условиях обычного пиролиза, когда глубина разложения исходных веществ достаточно велика, с определенной глубиной протекают и вторичные реакции, например разложение олефинов и диолефинов, образующиеся на первой стадии, реакции типа присоединения и т.д. Хотя скорость вторичных превращений в меньшей степени зависит от температуры, чем первичные, однако такая зависимость существует и характеризуется величинами энергии активации соответствующих реакций. Поэтому выходы продуктов реакций пиролиза углеводородов при различных температурах определяются не только зависимостью глубины превращения исходного вещества от температуры. Характер температурной зависимости выходов продуктов обычно более сложен и, как правило, устанавливается для различных видов сырья экспериментально.
Другим важным параметром пиролиза является время пребывания пиролизуемых веществ в зоне реакции, называемое иногда временем контакта. Под временем пребывания понимают промежуток времени, в течение которого поток реагирующего вещества находится в реакционном змеевике при таких температурах, когда реакция пиролиза протекает с значительной скоростью. Условной температурой начала реакции в случае углеводородов С5-С10 (прямогонный бензин) можно считать 650оС (см. Рисунок 1.2).
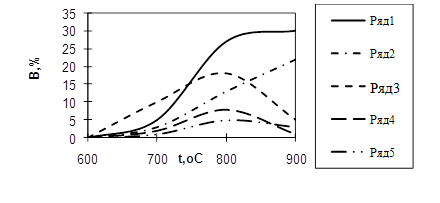
Рисунок 1.2 - Зависимость выходов В продуктов пиролиза прямогонного бензина в зотермическом реакторе от температуры t:
1 – С2Н4; 2 – СН4; 3 – С3Н6; 4 – С4Н8; 5 – С4Н6
Скорость первичных реакций, в ходе которых образуются олефины, в большей мере возрастает с увеличением температуры, чем скорость вторичных, и для каждого из промежуточных продуктов – низших олефинов – существует оптимальное, зависящее от температуры, время пребывания реагента, причем с повышением температуры величина оптимального времени пребывания уменьшается.
Таким образом, увеличение температуры пиролиза с одновременным соответствующим сокращением времени пребывания способствует достижению более высоких выходов целевых продуктов, в том числе этилена.
Для углеводородов C6, при низкой температуре термодинамическая стабильность углеводородов разных классов при одинаковом числе углеводородных атомов в молекуле понижается:
Парафины > Нафтены > Олефины > Ароматические
Однако с ростом температуры ввиду разной зависимости изобарно изотермического потенциала от температуры порядок изменяется на обратный:
Ароматические > Олефины > Нафтены > Парафины
Таким образом, при термическом воздействии на нефтепродукты следует ожидать изменения группового состава углеводородов. Процесс расщепления парафина может происходить с образованием молекул олефинов и парафина с более короткой цепью углеродных атомов, причем обратный процесс представляет собой алкилирование парафина олефинов:
Сm+nH2(m+n)+2↔CmH2m+CnH2n+2 (1.7)
Примерно до 600К изменение энергии Гиббса (dGо) больше нуля, и, следовательно, расщепление парафинов термодинамически невозможно, а может происходить лишь алкилирование. При более высокой температуре положение меняется на обратное, причем при 800К и выше расщепление является уже практически необратимым процессом [3].
Для олефинов склонность к расщеплению проявляется при более высокой температуре, чем для парафинов. В системе обратимых реакций пиролиза олефина и его димеризации (полимеризации)
Cm+nH2(m+n) ↔ CmH2m + CnH2n (1.8)
перемена знака в изменении dGo для низших олефинов происходит только при 750-800К. Это указывает на термодинамическую возможность их полимеризации при термическом и каталитическом пиролизе, но с преобладанием расщепления при более высоких температурах.
Известные законы термодинамики позволяют оценить роль давления при термическом расщеплении нефтепродуктов. Повышение давления способствует смещению равновесия в сторону полимеризации олефинов и алкилирования парафинов, поскольку данные реакции протекают с уменьшением объема. В связи с этим высокое давление препятствует глубокому расщеплению сырья и снижает образование углеводородов и особенно олефинов. Очевидно, понижение давления и повышения температуры должны действовать в обратном направлении.
Похожие работы
... структуры цепи линейного полипропилена. Стереоизомеры полипропилена (изотактические, синдиотактические, атактические и стереоблочные) существенно различаются по механическим, физическим и химическим свойствам. Атактический полипропилен представляет собой каучукоподобный продукт с высокой текучестью, температура плавления =80° С, плотность 0,85 г/см3 , хорошо растворяется в диэтиловом эфире и в ...
... процесса, более высокий выход спирта. Недостатками прямой гидратации является частая замена катализатора и использование более дорогих концентрированных этиленовых фракций. Процесс синтеза этилового спирта прямой гидратацией этилена технически более прогрессивен, чем сернокислотной гидратацией, поэтому он получил значительно большее распространение в промышленности. Характерной особенностью ...
... их не превышает 0,74, теплонапряженность камер низкая, дымовые газы покидают конвекционную камеру при сравнительно высокой температуре (450-500°С). В 60-е годы на АВТ и других технологических установках начали широко применяться печи беспламенного горения с излучающими стенками (рисунок 3.2). Беспламенные панельные горелки 1 расположены пятью рядами в каждой фронтальной стене камеры радиации. ...
... схема установки показана на рис. 5. Установки находятся в стадии проектирования. Для синтеза можно использовать также газ, полученный газификацией растительной биомассы паром. Таким образом, представлен процесс получения жидких моторных топлив из растительного сырья — отходов сельского хозяйства, лесодобычи и лесопереработки, который можно осуществить на передвижных или стационарных установках. ...

0 комментариев