Навигация
1.4.2. ЭНТРОПИЯ.
Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что означает от греческого «эволюция» ) и обладающей следующими свойствами :
а) Энтропия системы является экстенсивным свойством . Если система состоит из нескольких частей , то полная энтропия системы равна сумме энтропии каждой части .
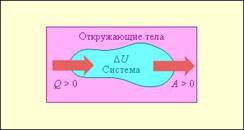
в) Изменение энтропии d S состоит из двух частей . Обозначим через dеS поток энтропии, обусловленный взаимодействием с окружающей средой , а через di S - часть энтропии , обусловленную изменениями внутри системы , имеем
d S = de S + di S (1.7)
Приращение энтропии di S обусловленное изменением внутри системы , никогда не имеет отрицательное значение . Величина di S = 0 , только тогда , когда система претерпевает обратимые изменения , но она всегда положительна , если в системе идут такие же необратимые процессы.
Таким образом
di S = 0 (1.8)
( обратимые процессы );
di S > 0 (1.9)
( необратимые процессы );
Для изолированной системы поток энтропии равен нулю и выражения (1.8) и (1.9) сводятся к следующему виду :
d S = di S > 0 (1.10)
( изолированная система ).
Для изолированной системы это соотношение равноценно классической формулировке , что энтропия никогда не может уменьшаться , так что в этом случае свойства энтропийной функции дают критерий , позволяющий обнаружить наличие необратимых процессов . Подобные критерии существуют и для некоторых других частных случаев .
Предположим , что система , которую мы будем обозначать символом 1 , находится внутри системы 2 большего размера и что общая система , состоящая системы 1 и 2 , является изолированной.
Классическая формулировка второго закона термодинамики тогда имеет вид :
d S = d S1 + d S2 ³ 0 (1.11)
Прилагая уравнения (1.8) и (1.9) в отдельности каждой части этого выражения , постулирует , что di S1 ³ 0 , di S2 ³ 0
Ситуация при которой di S1 > 0 и di S2 < 0 , а d( S1 + S2 )>0 , физически неосуществима . Поэтому можно утверждать , что уменьшение энтропии в отдельной части системы , компенсируемое достаточным возрастанием энтропии в другой части системы , является запрещенным процессом . Из такой формулировки вытекает , что в любом макроскопическом участке системы приращение энтропии , обусловленное течением необратимых процессов , является положительным. Под понятием « макроскопический участок » системы подразумевается любой участок системы , в котором содержится достаточное большое число молекул , чтобы можно было принебреч микроскопическими флуктуакциями. Взаимодействие необратимых процессов возможно лишь тогда, когда эти процессы происходят в тех же самых участках системы .
Такую формулировку второго закона можно было бы назвать « локальной » формулировка в противоположность « глобальной » формулировка классической термодинамики . Значение подобной новой формулировке состоит в том ,что на ее основе возможен гораздо более глубокий анализ необратимых процессов .
1.5 ТРЕТЬЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Открытие третьего начала термодинамики связано с нахождением химического средства - величины , характеризующих способность различных веществ химически реагировать друг с другом . Эта величина определяется работой W химических сил при реакции . Первое и второе начало термодинамики позволяют вычислить химическое средство W только с точностью до некоторой неопределенной функции . Чтобы определить эту функцию нужны в дополнении к обоим началам термодинамики новые опытные данные о свойствах тел . Поэтому Нернстоном были предприняты широкие экспериментальные исследования поведение веществ при низкой температуре .
В результате этих исследований и было сформулировано третье начало термодинамики : по мере приближения температуры к 0 К энтропия всякой равновесной системы при изотермических процессах перестает зависить от каких-либо термодинамических параметров состояния и в пределе ( Т= 0 К) принимает одну и туже для всех систем универсальную постоянную величину , которую можно принять равной нулю .
Общность этого утверждения состоит в том , что , во-первых , оно относится к любой равновесной системе и , во-вторых , что при Т стремящемуся к 0 К энтропия не зависит от значения любого параметра системы. Таким образом по третьему началу,
lin [ S (T,X2) - S (T,X1) ] = 0 (1.12)
или
lim [ dS/dX ]T = 0 при Т ® 0 (1.13)
где Х - любой термодинамический параметр (аi или Аi).
Предельно значение энтропии , поскольку оно одно и тоже для всех систем , не имеет никакого физического смысла и поэтому полагается равным нулю (постулат Планка). Как показывает статическое рассмотрение этого вопроса , энтропия по своему существу определена с точностью до некоторой постоянной (подобно, например, электростатическому потенциалу системы зарядов в какой либо точке поля). Таким образом , нет смысла вводить некую «абсолютную энтропию», как это делал Планк и некоторые другие ученые.
ГЛАВА 2
ОСНОВНЫЕ ПОНЯТИЯ И ПОЛОЖЕНИЯ СИНЕРГЕТИКИ.
САМООРГАНИЗАЦИЯ РАЗЛИЧНЫХ СИСТЕМ.
Около 50 лет назад в результате развития термодинамики возникла новая дисциплина - синергетика. Являясь наукой о самоорганизации самых различных систем - физических , химических , биологических и социальных - синергетика показывает возможность хотя бы частичного снятия междисциплинных барьеров не только внутри естественно научной отросли знания , но так же и между естественно научной и гумонитарной культурами .
Синергетика занимается изучением систем , состоящих из многих подсистем самой различной природы , таких , как электроны , атомы , молекулы , клетки , нейтроны , механические элементы , фотоны , органы , животные и даже люди.
При выборе математического аппарата необходимо иметь ввиду , что он должен быть применим к проблемам , с которыми сталкиваются физик , химик , биолог , электротехник и инженер механик. Не менее безотказно он должен действовать и в области экономики , экологии и социологии .
Во всех этих случаях нам придется рассматривать системы , состоящие из очень большого числа подсистем , относительно которых мы можем не располагать всей полной информацией . Для описания таких систем не редко используют подходы , основанные на термодинамики и теории информации.
Во всех системах , представляющих интерес для синергетики , решающую роль играет динамика. Как и какие макроскопические состояния образуются, определяются скоростью роста (или распада) коллективных «мод» . Можно сказать что в определенном смысле мы приходим к своего рода обобщенному дарвенизму , действие которого распознается не только на органический ,но и на неорганический мир : возникновение макроскопических структур обусловленных рождением коллективных мод под воздействием флуктуаций , их конкуренцией и , наконец, отбором «наиболее приспособленной» моды или комбинации таких мод.
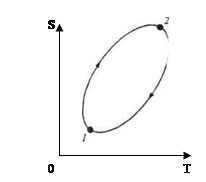
Ясно, что решающую роль играет параметр «время» . Следовательно , мы должны исследовать эволюцию систем во времени . Именно поэтому интересующие нас уравнения иногда называют «эволюционными».
Похожие работы
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... , не вызывая при этом никаких других изменений состояния системы. (Такую воображаемую машину принято называть вечным двигателем второго рода) 6. Обратимые и необратимые процессы По второму началу термодинамики в природе возможны процессы, при которых превращение теплоты в работу связано с компенсацией, и невозможны процессы, при которых такое превращение не сопровождается компенсацией. Это ...
... эффекта термодинамического процесса (2.5). Запишем: . (2.16) Выражение (2.16) и подобные ему, некоторые авторы называют обобщенной формулировкой I и II начала термодинамики. Преобразуем дифференциал , и подставим его в (2.5): . Из последнего равенства следует: , , . (2.17) Учитывая, что ...
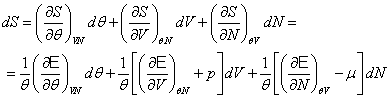
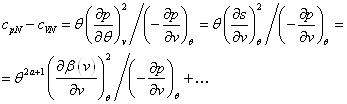
0 комментариев