Навигация
САМООРГАНИЗАЦИЯ РАЗЛИЧНЫХ СТСТЕМ И
2.2. САМООРГАНИЗАЦИЯ РАЗЛИЧНЫХ СТСТЕМ И
СЕНЕРГЕТИКА.
Переход от хаоса к порядку , происходящий при изменении значений параметров от до критических к сверхкритическим , изменяет симметрию системы . По этому такой переход аналогичен термодинамическим фазовым переходам . Переходы в неравновесных процессах называются кинетическими фазовыми переходами . В близи неравновесных фазовых переходов не существует непротиворечивого макроскопического описания . Флуктуации столь же важны , как и среднее значении . Например , макроскопические флуктуации могут приводить к новым типам не устойчивостей .
Итак , в дали от равновесия между химической , кинетической и пространственно-временной структурой реагирующих систем существует неожиданная связь . Правда , взаимодействие , определяющие взаимодействие констант скоростей и коэффициентов переноса , обусловлены короткодействующими силами ( силами валентности , водородными связями и силами Ван-Дер-Вальса) . Однако решения соответствующих уравнений зависят , кроме того , от глобальных характеристик . Для возникновения диссипативных структур обычно требуется , чтобы размеры системы превышали некоторое критическое значение - сложную функцию параметров , описывающих реакционно-диффузионные процессы . Мы можем по этому утверждать , что химические неустойчивости задают дальнейший порядок , посредством которого система действует как целое .
Если учесть диффузию , то математическая формулировка проблем , связанных с диссипативными структурами , потребует изучении дифференциальных уравнений в частных производных . Действительно , эволюция![]() концентрации компонент Х со временем определяется уравнением вида
концентрации компонент Х со временем определяется уравнением вида
![]() (2.4)
(2.4)
где первый член дает вклад химических реакций в изменении концентрации Хi и обычно имеет простой полиноминальный вид , а второй член означает диффузию вдоль оси r.
По истине поразительно , как много разнообразных явлений описывает реакционно-диффузное уравнение (2.4 ) , по этому интересно рассмотреть ² основное решение ² , которое бы соответствовала термодинамической ветви . Другие решения можно было бы получать при последовательных не устойчивостях , возникающих по мере удаления от состояния равновесия . Неустойчивости такого типа удобно изучать методами теории бифуркации [ Николис и Пригожин , 1977] . В принципе , бифуркация есть нечто иное , как возникновение при некотором критическом значении параметра нового решения уравнений . Предположим , что мы имеем химическую реакцию , соответствующую кинетическому уравнению [ Маклейн и Уолис , 1974] .
d X
¾ = a X (X-R) (2.5)
d t
Ясно что при R < 0 существует только одно решение , независящее от времени , X = 0 . В точке R = 0 происходит бифуркация , и появляется новое решение X = R .
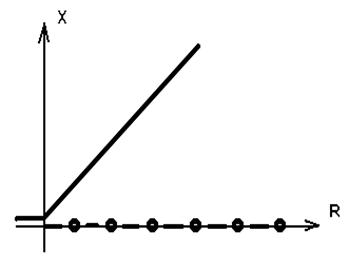
Рис. 2.3. Бифуркационная диограмма для уравнения ( 2.5.) .
Сплошная линия соответствует устойчивой ветви ,
точки - неустойчивой ветви .
Анализ устойчивости в линейном приближении позволяет проверить , что решение X = 0 при переходе через R = 0 становится неустойчивым , а решение X = R - устойчивым . В общем случаи при возрастании некоторого характеристического параметра р происходят последовательные бифуркации . На рисунке 2.4. показано единственное решение при р = р1 , но при
р = р2 единственность уступает место множественным решения .
Интересно отметить , что бифуркация в некотором смысле вводит в физику и в химию , историю - элемент , который прежде считался прерогативой наук занимающихся изучением биологическим , общественных и культурных явлений .
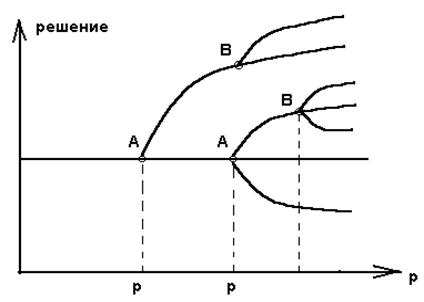
Рис. 2.4. Последовательные бифуркации :
А и А1 - точки первичных бифуркаций из
термодинамической ветви ,
В и В1 - точки вторичной бифуркации .
Известно , что при изменении управляющих параметров в системе наблюдаются разнообразные переходные явления . Выделим теперь из этих наблюдений определенные общие черты , характерные для большого числа других переходов в физико химических системах .
С этой целью представим графически (рис. 2.5) зависимость вертикальной компоненты скорости течения жидкости в некоторой определенной точке от внешнего ограничения , или , в более общем виде , зависимость переменной состояние системы Х (или х = Х - Хs ) от управляющего параметра l . Таким образом мы получим график , известный под названием бифуркационной диаграммы .
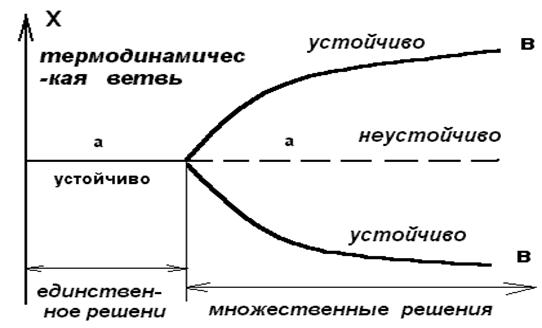
Рис. 2.5. Бифуркационная диаграмма :
а - устойчивая часть термодинамической ветви ,
а1 - не устойчивая часть термодинамической ветви ,
в1 ,в2 - диссипативные структуры , рожденные в
сверхкритической области .
При малых значения l возможно лишь одно решение , соответствующее состоянию покоя в бенаровском эксперименте .Оно представляет собой непосредственную экстрополяцию термодинамического равновесия , и подобно равновесно , характеризующейся важным свойством - асимптотической устойчивостью , поскольку в этой области система способна гасить внутренние флуктуации или внешнее возмущения . По этой причине такую ветвь состояний мы будем называть термодинамической ветвью . При переходе критического значения параметра l , обозначенного lc на рисунке 2.5. , состоящие на этой ветви становится неустойчивыми , так как флуктуации или малые внешние возмущение уже не гасятся . Действуя подобно усилителю , система отклоняется от стационарного состояния и переходит к новому режиму , в случае бенаровского эксперимента соответствующему состоянию стационарной конвекции . Оба этих режима сливаются при l = lc и различаются при l > lc . Это явление называется бифуркацией . Легко понять причины , по которым это явление следует ассоциировать с катастрофическими изменениями и конфликтами. В самом деле , в решающий момент перехода система должна совершить критический выбор ( в окрестности l = lc ) , что в задаче Бенара связано с возникновением право- или левовращательных ячеек в определенной области пространства ( рис. 2.5. , ветви в1 или в2 ) .
В близи равновесного состояния стационарное состояние асимптотических устойчивы (по теореме о минимальном производстве энтропии ) , по этому в силу непрерывности эта термодинамическая ветвь простирается во всей докритической области . При достижении критического значения термодинамическая ветвь может стать неустойчивой , так что любое , даже малое возмущение , переводит систему с термодинамической ветви в новое устойчивое состояние , которое может быть упорядоченным . Итак , при критическом значении параметром произошла бифуркация и возникла новая ветвь решений и , соответственно , новое состояние . В критической области , таким образом , событие развивается по такой схеме :
Флуктуация ® Бифуркация ®
неравновесный фазовый переход ®
Рождение упорядоченной структуры .
Бифуркация в широком понимании - приобретении нового качества движениями динамической системы при малом изменении ее параметров ( возникновение при некотором критическом значении параметра нового решения уравнений ) . Отметим , что при бифуркации выбор следующего состояния носит сугубо случайный характер , так что переход от одного необходимого устойчивого состояния к другому необходимому устойчивому состоянию проходит через случайное (диалектика необходимого и случайного) . Любое описание системы , претерпевающей бифуркацию , включает как детерминистический , так и вероятностный элементы , от бифуркации до бифуркации поведении системы детерминировано , а в окрестности точек бифуркации выбор последующего пути случаен . Проводя аналогию с биологической эволюцией можно сказать , что мутации - это флуктуации , а поиск новой устойчивости играет роль естественного отбора . Бифуркация в некотором смысле вводит в физику и химию элемент историзма - анализ состояния в1 , например , подразумевает знание истории системы , прошедшей бифуркацию .
Общая теория процессов самоорганизации открытых сильно не равновесных системах развивается на основе универсального критерия эволюции Пригожина - Гленсдорфа . Этот критерий является обобщением теоремы Пригожина о минимальном производстве энтропии . Скорость производства энтропии , обусловленная изменением термодинамических сил Х , согласно этому критерию подчиняется условию
dx P / t £ 0 (2.6)
Это неравенство не зависит не от каких предположений о характере связей между потоками и силами в условиях локального равновесия и носит по этому универсальный характер . В линейной области неравенство (2.6. ) переходит в теорему Пригожина о минимальном производстве энтропии . Итак , в неравновестной системе процессы идут так , т.е. система эволюционирует таким образом, что скорость производства энтропии при изменении термодинамических сил уменьшается ( или равна нулю в стационарном состоянии ).
Упорядоченные структуры , которые рождаются вдали от равновесия , в соответствии с критерием (2.6.) и есть диссипативные структуры .
Эволюция бифуркации и последующей самоорганизации обусловлено , таким образом , соответствующими не равновесными ограничениями .
Эволюция переменных Х будет описываться системой уравнений
![]() (2.7)
(2.7)
где функции F как угодно сложным образом могут зависить от самих переменных Х и их пространственных производных координат r и времени t . Кроме того , эти функции буду зависить от управляющих параметров , т.е. тех изменяющихся характеристик , которые могут сильно изменить систему . На первый взгляд кажется очевидным , что структура функции { F } будет сильно определятся типом соответствующей рассматриваемой системы . Однако , можно выделить некоторые основные универсальные черты , независящие от типа систем.
Решение уравнения (2.7) , если нет внешних ограничений , должны соответствовать равновесию при любом виде функции F . Поскольку равновесное состояние стационарно , то
Fi ({Xрав},lрав ) = 0 (2.8)
В более общем случае для неравновесного состояния можно аналогично написать условие
Fi ({X},l) = 0 (2.9)
Эти условия налагают определенные ограничения универсального характера , например, законы эволюции системы должны быть такими , чтобы выполнялось требование положительности температуры или химической концентрации, получаемых как решения соответствующих уравнений.
Другой универсальной чертой является нелинейным . Пусть , например некоторая единственная характеристика системы
удовлетворяет уравнению
![]()
![]() (2.10)
(2.10)
где k - некоторый параметр , l - внешние управляющие ограничения . Тогда стационарное состояние определяется из следующего алгебраического уравнения
l - kX = 0 (2.11)
откуда
Xs = l / k (2.12)
В стационарном состоянии , таким образом , значении характеристики , например , концентрации , линейно изменяется в зависимости от значений управляющего ограничения l , и имеется для каждого l единственное состояние Хs . Совершенно однозначно можно предсказать стационарное значение Х при любом l ,если иметь хотя бы два экспериментальных значения Х
(l ) .Управляющий параметр может , в частности , соответствовать степени удаленности системы от равновесия . Поведение в этом случае системы очень похожи на равновесии даже при наличии сильно неравновесных ограничений .
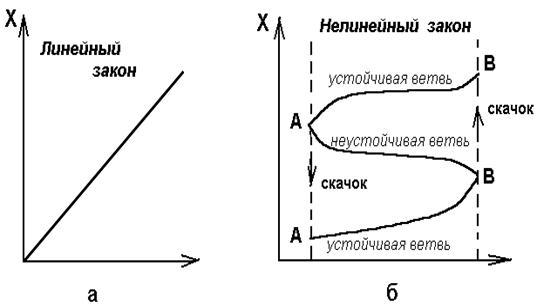
Рис. 2.6. Иллюстрация универсальной черты нелинейности в самоорганизации структур .
Если же стационарное значение характеристики Х не линейно зависит от управляющего ограничения при некоторых значениях , то при одном и том же значении имеется несколько различных решений . Например , при ограничениях система имеет три стационарных решения , рисунок 2.6.в. Такое универсальное отличие от линейного поведения наступает при достижении управляющим параметром некоторого критического значения l - проявляется бифуркация. При этом в нелинейной области небольшое увеличение может привести к неодекватно сильному эффекту - система может совершить скачок на устойчивую ветвь при небольшом изменении вблизи критического значения l , рисунок 2.6.в. Кроме того из состояний на ветви А1В могут происходить переходы АВ1 ( или наоборот ) даже раньше , чем будут достигнуты состояния В или А , если возмущения накладываемые на стационарное состояние , больше значение , соответствующего промежуточной ветви А В . Возмущениями могут служить либо внешнее воздействие либо внутренние флуктуации в самой системе . Таким образом , системе с множественными стационарными состояниями присуще универсально свойствам внутренне возбудимость и изменчивости скачкам .
Выполнение теоремы по минимально производстве энтропии в линейной области , а, как обобщение этой теоремы , выполнение универсального критерия (2.6.) и в линейной , и в нелинейной области гарантируют устойчивость стационарных неравновесных состояний. В области линейности необратимых процессов производство энтропии играет такую же роль , как термодинамические потенциалы в равновесной термодинамике . В нелинейной области величина dP / dt не имеет какого либо общего свойства , однако , величина dx P/dt удовлетворяет неравенству общего характера (2.6. ) , которая является обобщением теоремы о минимальном производстве энтропии .
Похожие работы
... и химическим процессам, происходящим в веществе, в различных системах. Важным достижением на пути этого процесса интеграции знаний было открытие фундаментального закона природы - закона сохранения и превращения энергии. Основатель термодинамики С. Карно в своем труде "Размышления о движущей силе огня и о машинах, способах развивать эту силу" пишет: "Тепло - это не что иное, как движущая сила, ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
... , не вызывая при этом никаких других изменений состояния системы. (Такую воображаемую машину принято называть вечным двигателем второго рода) 6. Обратимые и необратимые процессы По второму началу термодинамики в природе возможны процессы, при которых превращение теплоты в работу связано с компенсацией, и невозможны процессы, при которых такое превращение не сопровождается компенсацией. Это ...
... эффекта термодинамического процесса (2.5). Запишем: . (2.16) Выражение (2.16) и подобные ему, некоторые авторы называют обобщенной формулировкой I и II начала термодинамики. Преобразуем дифференциал , и подставим его в (2.5): . Из последнего равенства следует: , , . (2.17) Учитывая, что ...
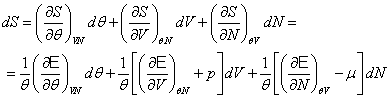
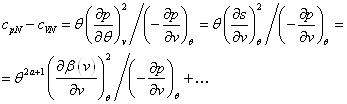
0 комментариев