Навигация
Теоретические основы принятого метода
1.3 Теоретические основы принятого метода
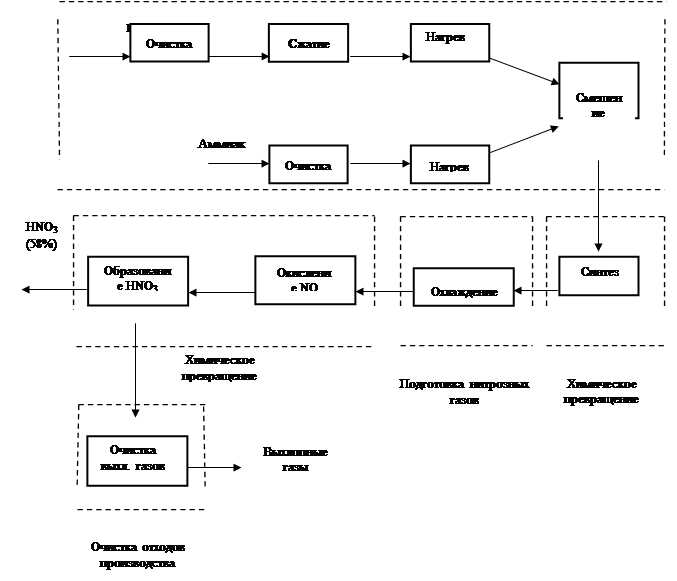
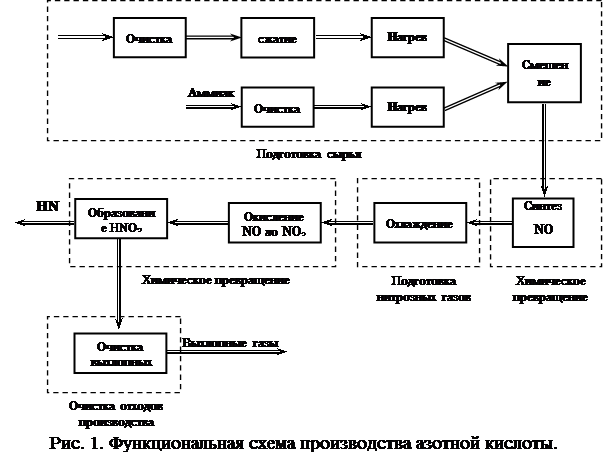
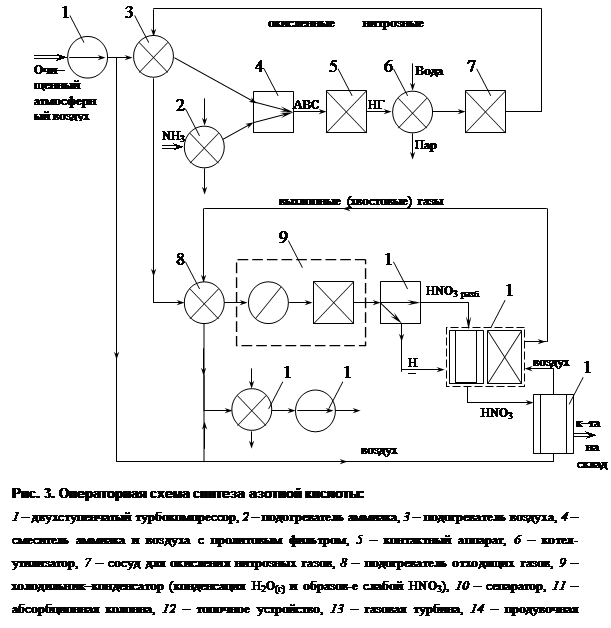
Неконцентрированную азотную кислоту получают контактным окислением аммиака в две стадии:
- первая стадия - контактное окисление аммиака в оксид азота (II)
4NH3 + 5О2 = 4NO + 6Н2О + 904 кДж (2)
- вторая стадия - окисление оксида азота (II) в высшие оксиды и поглощение их водой с образованием кислоты
2NO + О2 = 2NO2 + 212,7 кДж (3)
3NО2 + Н2О = 2НNO3 + NO + 73,6 кДж (4)
Суммарная реакция получения азотной кислоты может быть представлена уравнением:
NH3 + 2О2 = НNO3 + Н2О + 329,5 кДж
Производство неконцентрированной азотной кислоты осуществляется комбинированным способом: окисление аммиака происходит под атмосферным давлением, абсорбция оксидов азота происходит под давлением 0,35 МПа (3,5 кгс/см2).
Так как расходуется воздух на окисление, то в продукте реакции всегда находится азот.
В зависимости от катализатора и условий проведения процесса преобладают те или иные реакции. Состав конечных продуктов определяется избирательностью катализатора. Катализаторами для процесса являются следующие металлы: Pt, Pl, Cu, Ag, Ni, Au, Fe, W, Ti.
Достоинства платины:
1) Платина наиболее активна для реакции, обеспечивает при температуре 600-1000 оС высокий выход оксида азота (до 99%) при времени контакта 1· 10-4 с.
2) Платина имеет температуру инициации реакции, равную 195-200 оС.
3) Имеет хорошую пластичность, ковкость, тягучесть, что делает сплавы платины самыми лучшими катализаторами окисления аммиака.
Недостатки платины:
1) Ее склонность к разрушению при температуре конверсии под воздействием реакционной смеси.
2) Подверженность влиянию большого количества ядов, поэтому исследовались и применяются сплавы платины с различными металлами.
Катализатор применяют в виде сеток. Эта форма удобна в эксплуатации, характеризуется минимальным вложением платиноидов и позволяет применять наиболее простой и удобный в эксплуатации тип контактного аппарата. Для изготовления сеток используют проволоку Д=0.06-0.09 мм. Размер стороны ячейки 0,22 мм, число ячеек1024 на 1 см2.
Окисление аммиака до NO относится к гетерогенным системам. Скорость реакции окисления зависит в первую очередь от скорости диффузии O2 и NH3 к поверхности катализатора. Скорость диффузии аммиака к поверхности платиноидного катализатора ниже, чем скорость диффузии кислорода, поэтому она и является определяющей скорость окисления аммиака до NO.
Скорость окисления зависит от времени контактирования, температуры, давления, соотношения NH3 : O2.
Увеличение времени пребывания АВС в зоне катализа, т.е. уменьшение скорости газового потока, ведет к образованию элементарного азота. Увеличение скорости газа выше оптимальной уменьшает время пребывания газовой смеси в зоне катализа, что ведет к проскоку аммиака в поток нитрозного газа.
Процесс окисления оксида в диоксид осуществляется кислородом, находящимся в нитрозном газе.
2NO2 + O2↔2NO2 + 112,3 кДж (5)
2NO2↔N2O4 + 56,9 кДж (6)
NO2+ NO↔ N2O3 + 40 кДж (7)
Реакция 2 протекает только в жидкой фазе, а 1 и 3 – газовой. Все реакции экзотермические, обратимы, идущие с понижением объема, без катализатора.
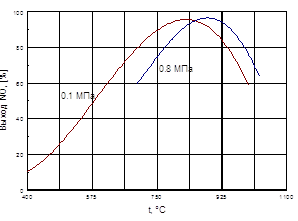
По принципу Ле-Шателье с повышением температуры равновесие реакции сдвигается влево, что приводит к снижению выхода NO2. Для ускорения этой реакции целесообразно применять повышенные давления, пониженные температуры, а также повышенные концентрации NO и O2. Скорость реакции пропорциональна квадрату концентрации NO в газовой смеси и концентрации O2.
Нитрозные газы, поступающие на абсорбцию, содержат NO2, N2O3, и NO. Все эти оксиды кроме NO реагируют с водой с образованием азотной кислоты. Суммарно процесс образования азотной кислоты описывается в виде следующих уравнений:
3NO2+H2O=2HNO3 + NO (8)
3N2O3 + H2O = 2HNO3 + 4NO (9)
Реакции экзотермичны, обратимы, гетерогенные, непрерывные, с уменьшением газового объема.
Полностью переработать оксиды азота в азотную кислоту при водной абсорбции невозможно. В газах, выходящих из абсорбционной колонны, всегда будут присутствовать оксиды азота, содержание которых зависит от условий их поглощения.
При избытке оксида азота будет происходить разложение азотной кислоты, поэтому необходимо вводить дополнительный кислород для максимального превращения NO в NO2.
Понижение температуры на 10 ˚С увеличивает скорость поглощения оксида азота в 2,5 раза, а скорость окисления NO в NO2 в 1,5 раза. Практически установлено, что температура абсорбции должна быть 20-35 ۫ С.
При увеличении давления: увеличивается скорость поглощения оксидов, но концентрация азотной кислоты повышается незначительно; повышается растворимость NO2 азотной кислоте, а это является большим минусом, поэтому азотная кислота после абсорберов подают в продувочную колонну, где ее продувают воздухом, удаляя NO2, продувочный газ возвращают в систему, а очищенная кислота идет на склад.
При тепловых процессах тепло передается от одного вещества к другому. Для самопроизвольного переноса одного из этих веществ должно быть более нагрето, чем другое. Вещество с более высокой температурой, которое в процессе теплообмена отдает тепло, называется горячим теплоносителем, а вещество с более низкой температурой, принимающее тепло, - холодным теплоносителем.
Существуют два основных способа проведения тепловых процессов:
1) Передача тепла непосредственным соприкосновением: теплоносители обычно смешиваются друг с другом, что не всегда допустимо; поэтому данный способ применяется сравнительно редко, хотя он значительно проще в аппаратурном оформлении.
2) Передача тепло через стенку: теплоносители не смешиваются и каждый из них движется по отдельному каналу; поверхность стенки, разделяющей теплоносители, используется для передачи тепла и называется поверхностью теплообмена.
Различают установившиеся и неустановившиеся процессы теплоотдачи.
При установившемся (стационарном) процессе температуры в каждой точке аппарата не изменяются во времени. При неустановившемся (нестационарном) процессе температуры изменяются во времени.
Передача тепла от одного тело к другому может происходить посредством теплопроводности, конвекции и лучеиспускания.
Нагревающие агенты: водяной пар (150-170 ˚С), пары высококипящих жидкостей (выше 150-170 ˚С), горячие газы (от 400 до 700-1000 ˚С), электрический ток (1000-2000 ˚С).
Охлаждающие агенты: воздух , вода (40-50 ˚С), низкотемпературные агенты (ниже 5-20 ˚С).
Похожие работы
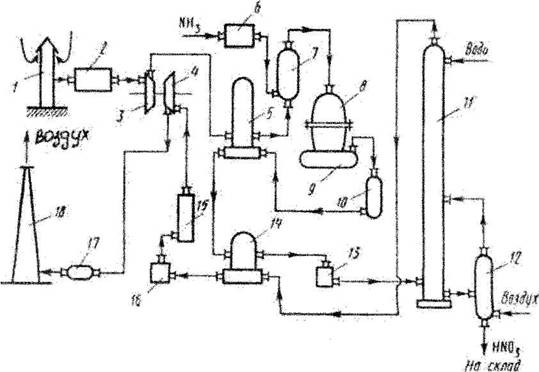
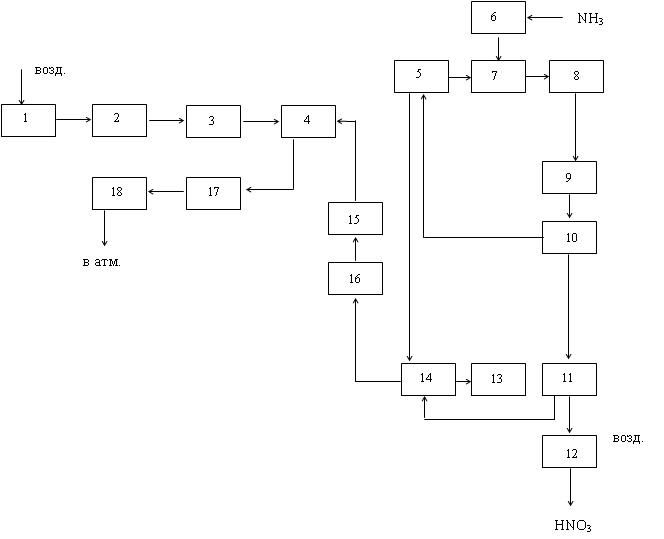
... + 50 2 = 4NO + 6Н2О 2NO+O2=2NO2 3NO2 + H2O = 2NО3 + N0 NH3 + 2О2 = HNO3 + Н2О + 421,2 Технологическая схема Рис. 3. Технологическая схема производства азотной кислоты 1-воздухозаборная труба; 2-воздухоочиститель; 3-газовый компрессор; 4-газовая турбина; 5-воздухоподогреватель; 6-испаритель аммиака; 7-смеситель с фильтром; 8-контактный аппарат; 9,17-котёл-утилизатор; 10-окислитель с ...
... в производстве концентрированной азотной кислоты по методу прямого синтеза. В отдельных случаях используется для обогащения АВС при получении неконцентрированной азотной кислоты. СОВРЕМЕННОЕ СОСТОЯНИЕ ТЕХНОЛОГИИ ПРОИЗВОДСТВА НЕКОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТЫ. Азотная кислота и главным образом ее природная соль - натриевая селитра известны с давних времен. В 778 г. Арабский ученый Гебер ...
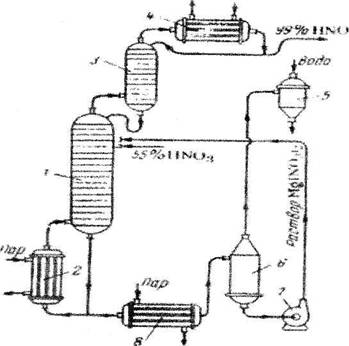
... очистки выхлопных газов, выпускающий продукцию в виде 53–58% -ной HNO3. Технологическая схема этого производства в упрощенном варианте представлена на рисунке 5. Подготовка сырья Рис.5 Схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины: 1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – ...
... способствует образованию NO2. При температурах до 100 ºС равновесие реакции практически полностью сдвинуто в правую сторону. Окисление диоксида азота – самая медленная стадия получения азотной кислоты. Она сильно зависит от концентрации реагентов, давления температуры. Применение воздуха, обогащенного кислородом (или чистого кислорода) позволяет получать НГ[2] с повышенным содержанием ...


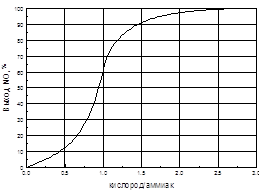
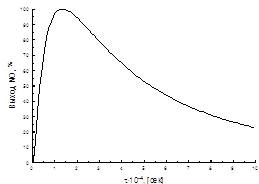


0 комментариев