Навигация
Расчет материального баланса на 1 агрегат в час
2.2 Расчет материального баланса на 1 агрегат в час
Определяем теоретическое количество аммиака, необходимого для получения 4,5 т\час моногидрата азотной кислоты по реакции:
NH3 + 2O2 = HNO3 + H2O (1)
Так как на получение 1 моль моногидрата азотной кислоты расходуется 1 моль аммиака, то для получения 71,42 кмоль моногидрата соответственно необходимо 71,42 кмоль аммиака.
Расход аммиака с учетом степени окисления и абсорбции окислов азота составит:
С1NH3 = П \ 0,97 * 0,99 (2.1)
Где П – нагрузка по моногидрату на 1 агрегат, кмоль\час;
0,97 – степень окисления аммиака (дольные единицы);
0,99 – степень абсорбции (дольные единицы);
С1NH3 = 5,130 \ 0,97 * 0,99 = 5,342 кг или 5342,08 \ 17 = 314,23 кмоль
Определяем расход сухого воздуха при содержании аммиака в АВС 10,3 % об.
314,23 кмоль аммиака соответствует 10,3 % об.
Х кмоль воздуха соответствует 89,7 % об.
Х1 = 2736,54 кмоль\час воздуха.
Количество водяных паров, вносимых потоком воздуха при среднем содержании 0,2 % об.
2736,54 кмоль воздуха – 98,2 % об.
Х кмоль воды – 0,2 % об.
Х2 = 5,57 кмоль\час водяных паров.
Количество кислорода, поступающего в систему вместе с потоком воздуха.
С1О2 = х1 * 0,21 (2.2)
Где х1 – расход сухого воздуха;
0,21 – содержание кислорода в воздухе.
С1О2 = 2736,54 * 0,21 = 574,67 кмоль \ час
Количество азота, поступающего в систему с потоком воздуха.
С1N2 = х1 * 0,79 (2.3)
Где 0,79 – содержание азота в воздухе.
С1N2 = 2736,54 * 0,79 = 2161,86 кмоль \ час
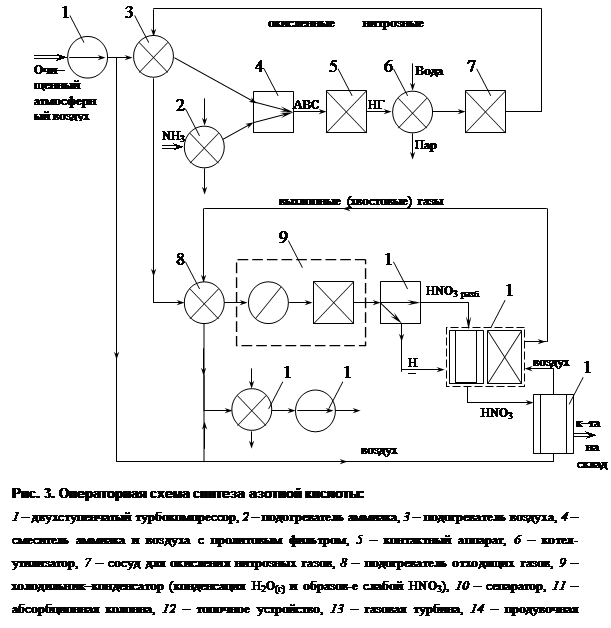
Таблица 7 – Приход АВС в контактный аппарат.
| Компонент | Кмоль | % об. | Кг | % вес. |
| Аммиак | 314,23 | 10,27 | 5342,08 | 6,33 |
| Кислород | 574,67 | 18,80 | 18389,44 | 21,80 |
| Азот | 2161,86 | 70,73 | 60532,08 | 71,75 |
| Вода | 5,57 | 0,20 | 100,26 | 0,12 |
| Итого: | 3056,33 | 100 | 84363,86 | 100 |
Состав после окисления аммиака в соответствии с принятой степенью конверсии 97 % рассчитываем по следующим реакциям:
4NH3 + 5O2 = 4NO + 6H2O (2)
4NH3 + 3O2 = 2N2 + 6H2O (3)
Определяем количество оксида азота, образовавшегося по реакции (2) в час:
С1NO = С1NH3 * K1 (2.4)
С1NO = 314.23 * 0.97 = 304.803 кмоль \ час
Определяем количество инертного азота, образующегося по реакции (3) в час:
С2N2 = С1NH3 - С1NO \ 2 (2.5)
Где С1NH3 - расход аммиака;
С1NO – количество оксида азота.
С2N2 = 314,23 – 304,803 \ 2 = 4,71 кмоль\ час
Всего инертного газа в газовой смеси после окисления аммиака
С1N2общ = С1N2 + C2N2 (2.6)
Где С1N2 – количество азота;
C2N2 - количество инертного азота.
С1N2общ = 2161,86 + 4,71 = 2166,57 кмоль\час
Образующаяся вода по реакциям, которая находится в паровом состоянии:
Похожие работы
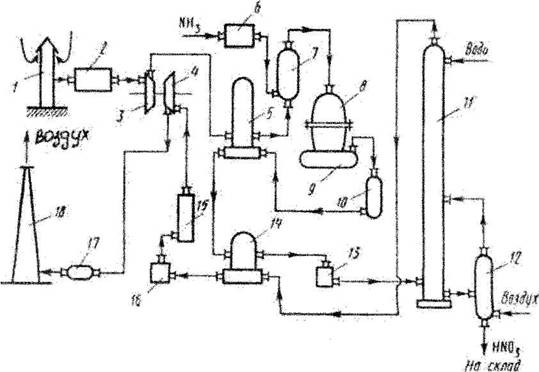
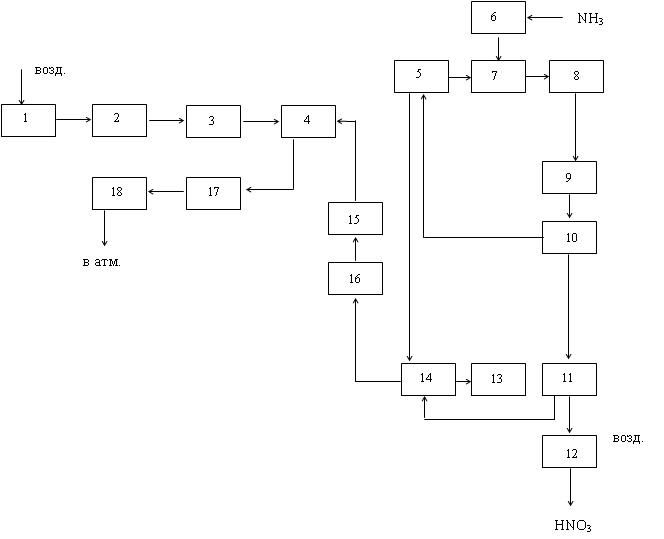
... + 50 2 = 4NO + 6Н2О 2NO+O2=2NO2 3NO2 + H2O = 2NО3 + N0 NH3 + 2О2 = HNO3 + Н2О + 421,2 Технологическая схема Рис. 3. Технологическая схема производства азотной кислоты 1-воздухозаборная труба; 2-воздухоочиститель; 3-газовый компрессор; 4-газовая турбина; 5-воздухоподогреватель; 6-испаритель аммиака; 7-смеситель с фильтром; 8-контактный аппарат; 9,17-котёл-утилизатор; 10-окислитель с ...
... в производстве концентрированной азотной кислоты по методу прямого синтеза. В отдельных случаях используется для обогащения АВС при получении неконцентрированной азотной кислоты. СОВРЕМЕННОЕ СОСТОЯНИЕ ТЕХНОЛОГИИ ПРОИЗВОДСТВА НЕКОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТЫ. Азотная кислота и главным образом ее природная соль - натриевая селитра известны с давних времен. В 778 г. Арабский ученый Гебер ...
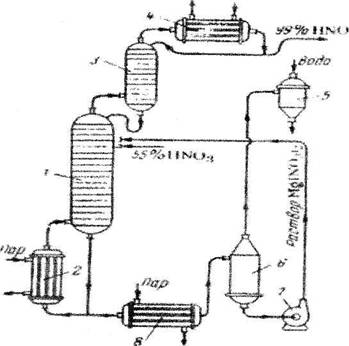
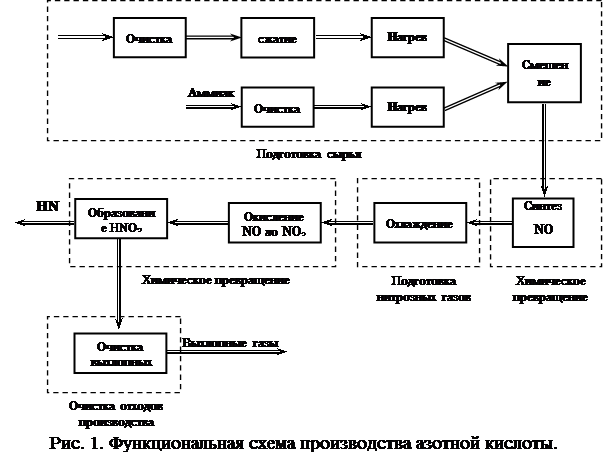
... очистки выхлопных газов, выпускающий продукцию в виде 53–58% -ной HNO3. Технологическая схема этого производства в упрощенном варианте представлена на рисунке 5. Подготовка сырья Рис.5 Схема производства азотной кислоты под давлением 0,716 МПа с приводом компрессора от газовой турбины: 1 – фильтр воздуха; 2 – реактор каталитической очистки; 3 – топочное устройство; 4 – ...
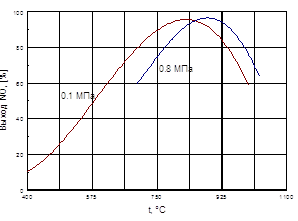
... способствует образованию NO2. При температурах до 100 ºС равновесие реакции практически полностью сдвинуто в правую сторону. Окисление диоксида азота – самая медленная стадия получения азотной кислоты. Она сильно зависит от концентрации реагентов, давления температуры. Применение воздуха, обогащенного кислородом (или чистого кислорода) позволяет получать НГ[2] с повышенным содержанием ...


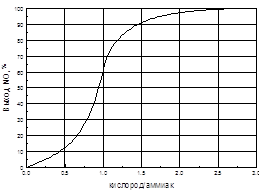
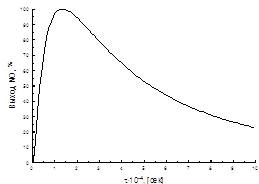


0 комментариев