Навигация
МЕТОД КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
5. МЕТОД КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Комплексонометрия − раздел титриметрического анализа, основанный на реакциях комплексообразования между определяемым ионом металла (М) и титрантом (комплексоном).
Катионы металла (М), содержащие вакантные d-орбитали, реагируют с донорами электронной пары − лигандами (L), образуя координационные соединения − хелаты. Хелатообразующий лиганд с двумя донорными группами, участвующими в образовании координационной связи, называется бидентатным; лиганд с тремя донорными группами − тридентатным и т.д.
Хелатообразование всегда протекает в одну стадию, тогда как при образовании комплекса образуется несколько промежуточных соединений.
В аналитических целях реакцию комплексообразования можно использовать, только если образуется комплекс типа МL состава 1:1, в котором к каждому металла присоединен один лиганд, поскольку для таких систем характерно наибольшее изменение значения рМ вблизи точки эквивалентности.
Наиболее широкое применение в комлексонометрии нашли комплексоны. Это полиаминокарбоновые кислоты, образующие с ионами металлов комплексные соединения: этилендиаминтетрауксусная кислота (ЭДТУ) − комплексон II и ее двунатриевая соль (ЭДТА), которую называют комплексон III или трилон Б:
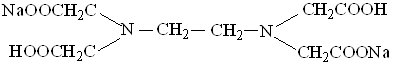
Препарат в виде белого растворимого в воде порошка является кристаллогидратом состава Nа2Н2Т · 2Н2О, где Т − анион ЭДТУ. ЭДТУ − слабая четырехосновная кислота (Н4Т), характеризующаяся четырьмя ступенями диссоциации: рКI = 2,0; рКII = 2,67; рКIII = 6,16; рКIV = 10,26. Близкие значения рКI и рКII показывают, что отщепление первых двух протонов протекает легче, чем отщепление двух оставшихся.
Данная соль относительно хорошо растворима в воде и диссоциирует, как сильный электролит:
Nа2Н2Т → 2Nа+ + Н2Т2−
Трилон Б взаимодействует со всеми катионами металлов II−IV аналитических групп. Реакции взаимодействия трилона Б с катионами металлов выражают уравнениями:
М2+ + Н2Т2−![]() МТ2− + 2Н+
МТ2− + 2Н+
М3+ + Н2Т2−![]() МТ− + 2Н+
МТ− + 2Н+
М4+ + Н2Т2−![]() МТ + 2Н+
МТ + 2Н+
Таким образом, ЭДТА реагирует с ионами металлов с образованием комплекса 1:1, независимо от заряда катиона. В результате реакции взаимодействия происходит замещение двух катионов водорода, поэтому fэкв(М) = ½.
Указанные равновесия зависят от рН раствора. Для обеспечения полноты протекания реакции значение рН поддерживают постоянным, применяя для этого соответствующий буферный раствор. Чем выше заряд иона металла, тем прочнее образующийся комплексонат и тем более кислая среда допускается в ходе титрования.
Водные растворы комплексона III и большинства комплексонатов металлов бесцветны. Конец титрования обычно определяют с помощью металлиндикаторов. Это органические вещества, образующие цветные комплексные соединения с определяемым катионом. Свободный индикатор и его комплекс с ионом металла окрашены неодинаково. Устойчивость комплекса индикатора с металлом должна быть высокой, но ниже устойчивости комплекса металла с комплексоном.
Раствор трилона Б готовят из высушенной при 80°С навески. Для определения точной концентрации раствора трилон Б используют стандартный раствор МgSО4, приготовленный из стандарт-титра или навеску металлического цинка, растворенную в соляной или серной кислоте.
5.1. Стандартизация раствора трилон Б
Для определения точной концентрации раствора трилон Б применяется стандартный раствор сульфата магния, приготовленный из стандарт-титра. Концентрация раствора МgSО4 = 0,01 моль/л. В качестве индикатора используется кислотный хромовый темно-синий. В основе определения лежат реакции:
1) образование комплекса катиона магния с индикатором:
рН ~ 9
Мg2+ + Нind2−![]() МgInd22− + 2Н+
МgInd22− + 2Н+
синий винно-красн.
2) образование более прочного комплекса катиона магния с рабочим раствором трилон Б с выделением свободной формы индикатора:
рН ~ 9
МgInd22− + Nа2Н2Т ![]() Nа2МgТ + 2Нind2−
Nа2МgТ + 2Нind2−
винно-красн. раб.р-р бесцв. синий
Методика анализа
В колбу для титрования последовательно из бюретки отмеряется 4,0; 5,0 и 6,0 мл стандартного 0,01 М раствора МgSО4, цилиндром отмеряется 5 мл аммиачного буферного раствора, добавляется 1 капля индикатора. Объем в колбе примерно вдвое разбавляется дистиллированной водой, смывая капли растворов со стенок внутрь колбы. Полученный раствор титруют трилоном Б до перехода винно-красной окраски раствора в синюю. Расчет концентрации раствора трилона Б производится на основе закона эквивалентов:
N(МgSО4) V(МgSО4)
N(Nа2Н2Т) = ---------
V(Nа2Н2Т)
По трем значениям концентрации раствора трилон Б рассчитывается среднее значение концентрации этого раствора.
Лабораторная работа №11
"Определение содержания Аl3+ методом обратного титрования"
Метод определения основан на том, что в кислой среде катионы алюминия образуют с трилоном Б прочное комплексное соединение (lg β = 16,13). Для разрушения гидратной оболочки комплекса и увеличения скорости реакции образования комплексоната алюминия проводят кипячение раствора соли алюминия с трилоном Б, взятом в избытке. По окончании реакции избыток трилона Б оттитровывается стандарным раствором сульфата цинка. В качестве индикатора используется ксиленоловый оранжевый, который в слабокислом растворе (рН ~ 5) в присутствии уротропина (гексаметилтетраамина) имеет лимонно-желтую окраску. От избыточной капли раствора сульфата цинка окраска индикатора меняется на красно-розовую за счет образования комплекса цинка с индикатором.
В основе определения лежат следующие реакции:
рН ~ 5
Аl3+ + Н2Т2−![]() АlТ2− + 2Н+ + Н2Т2−
АlТ2− + 2Н+ + Н2Т2−
отмерен.изб. остаток
Н2Т2− + ZnSО4![]() ZnТ2− + 2Н+
ZnТ2− + 2Н+
остаток 2-ой раб.р-р
ZnSО4 + Нind2−![]() ZnInd22− + 2Н+
ZnInd22− + 2Н+
изб.капля желт. красн.-роз.
По уравнению реакции и с учетом закона эквивалентов содержание алюминия определяется:
q(Аl3+) = q(Nа2Н2Т) − q(ZnSО4).
Методика анализа
В мерную колбу получают раствор задачи, доводят до метки дистиллированной водой и тщательно перемешивают. В колбу для титрования пипеткой переносят аликвотную часть задачи, добавляют из бюретки 10 мл рабочего раствора трилон Б и 3 мл 2 н раствора НNО3. Колбу накрывают стеклянной воронкой и раствор кипятят в течении 5 мин. Затем воронку над колбой ополаскивают дистиллированной водой, чтобы исключить потери раствора, и раствор охлаждают до комнатной температуры. В колбу для титрования добавляют 2 г предварительно взвешенного на технических весах уротропина. Содержимое колбы перемешивают круговыми движениями до растворения уротропина и добавляют на кончике шпателя ксиленоловый оранжевый. Смесь титруют вторым рабочим раствором ZnSО4 до перехода окраски индикатора из желтой в красно-розовую. Расчет содержания алюминия (III) в задаче проводят по среднему результату, полученному из данных титрования трех параллельных опытов:
N(Nа2Н2Т) · V(Nа2Н2Т) N(ZnSО4) · V(ZnSО4)
m(Аl3+) = 10 ·│----------------------------- − --------│· Мэ(Аl)
1000 1000
Лабораторная работа №12
"Определение общей жесткости воды"
Наличие Са2+ и Мg2+ в природных водах определяет их жесткость. Различают карбонатную (временную) и некарбонатную (постоянную). Первая обусловлена присутствием бикарбонатов (Са(НСО3)2 и Мg(НСО3)2), вторая − сульфатами (СаSО4 и МgSО4) или их хлоридами (СаСl2 и МgСl2). Карбонатную жесткость устраняют кипячением или прибавлением к воде гидроксида кальция:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О
Постоянную жесткость устраняют прибавлением к воде соды:
СаSО4 + Nа2СО3 → СаСО3↓ + Nа2SО4
Сумма временной и постоянной жесткости воды составляет общую жесткость, выраженную мг-экв ионов Са2+ и Мg2+ на 1л воды.
В основе определения лежат реакции:
Мg2+ + Нind2−![]() МgInd22− + 2Н+
МgInd22− + 2Н+
синий винно-красн.
Са2+ + Нind2−![]() СаInd22− + 2Н+
СаInd22− + 2Н+
синий винно-красн.
рН ~ 9
(Са)МgInd22− + Nа2Н2Т ![]() Nа2(Са)МgТ + 2Нind2−
Nа2(Са)МgТ + 2Нind2−
винно-красн. раб.р-р бесцв. синий
Методика анализа
Пробу воды в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают. В колбу для титрования пипеткой отмеряют аликвотную часть исследуемого раствора, добавляют 5 мл аммиачного буферного раствора, разбавляют дистиллированной водой, смывая капли растворов со стенок внутрь колбы, и 1 каплю хром темно-синего.
Смесь титруют стандартным раствором трилона Б до перехода окраски индикатора из винно-красной в синюю. Определение повторяют трижды и вычисляют значение среднего объема трилона Б Vср(Nа2Н2Т), мл.
Результаты определения выражают суммарным количеством миллиграмм-эквивалентов (q) ионов кальция и магния в одном литре исследуемой пробы:
Vср(Nа2Н2Т) · N(Nа2Н2Т) · 1000
q = ----------------------------------------- ,
Vп
где Vп − объем пипетки, мл.
6. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
|
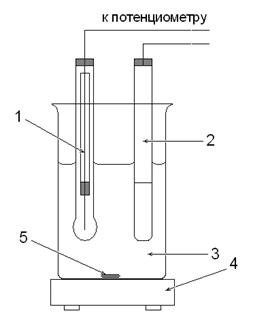
| 1. Индикаторный стеклянный электрод 2. Насыщенный хлорсеребряный электрод 3. Исследуемый раствор 4. Магнитная мешалка 5. Магнитный стержень |
Рис. 1. Ячейка для определения рН раствора
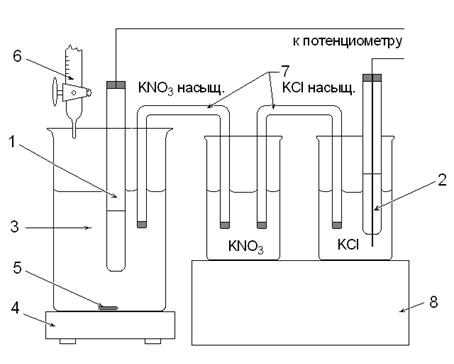
1. Индикаторный серебряный электрод. 2. Насыщенный хлорсеребряный электрод. 3. Исследуемый раствор. 4. Магнитная мешалка. 5. Магнитный стержень. 6. Бюретка с рабочим раствором AgNO3. 7. Мостики. 8. Штатив.
Рис. 2. Ячейка для определения галогенид-ионов.
Установка для потенциометрического титрования состоит из внешнего источника тока, чувствительного гальванометра (или постоянного усилителя), электролитической ячейки и регистрирующего прибора со шкалой в единицах рН или вольтах (см. рис. 1 и 2).
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев