Навигация
Стандартизация раствора тиосульфата натрия
3.4. Стандартизация раствора тиосульфата натрия
В основе определения лежат следующие реакции:
K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 + 7H2O + 3I2
станд. в-во
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
раб.р-р
По уравнению реакции: n(Na2S2O3) = 6n(K2Cr2O7) = n(1/6 K2Cr2O7)
Раствор бихромата калия Eº(Cr2O72−/2Cr3+) = 1.33 В готовят по точной навеске в мерной колбе. Расчет интервала навески проводят согласно методике (см.раздел 2.2.1) исходя из приблизительной концентрации раствора Na2S2O3 = 0,05 мг-экв/мл.
Методика анализа
В колбу для титрования помещают 1 г йодистого калия, цилиндром отмеряют 5 мл 4 н серной кислоты и отмеряют пипеткой аликвотную часть приготовленного раствора бихромата калия.
Смесь в колбе для титрования перемешивают круговыми движениями до растворения йодида калия и для завершения реакции помещают на 5 мин в темное место.
Затем выделившийся йод титруют раствором тиосульфата натрия до получения светло-желтой (соломенной) окраски, к раствору добавляют пипетку раствора крахмала и продолжают титрование до исчезновения синей окраски.
По результатам трех титрований вычисляют средний объем Vср(Nа2S2О3), мл и вычисляют концентрацию раствора. Стандартизованный раствор тиосульфата натрия используют для определения точной концентрации рабочего раствора йода.
3.5. Стандартизация раствора йода
В основе определения лежит реакция:
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
раб.р-р 2-ой раб.р-р
По закону эквивалентов: q(I2) = q(Nа2S2О3)
Методика анализа
В колбу для титрования из бюретки последовательно отмеряют 4,0; 5,0 и 6,0 мл раствора йода и титруют стандартизованным раствором тиосульфата натрия до появления светло-желтого окрашивания раствора, затем добавляют пипетку раствора крахмала и продолжают титрование до исчезновения синей окраски.
На основании полученных результатов по закону эквивалентов рассчитывают концентрацию раствора йода:
N(Nа2S2О3) V(Nа2S2О3) = N(I2) V(I2)
Лабораторная работа №7
"Определение гексацианоферрат(II) калия"
Сущность определения заключается в способе обратного титрования: к аликвотной части задачи добавляют отмеренный избыток раствора I2. Его эквивалентное количество взаимодействует с определяемым веществом К4[Fе(СN)6], а остаток титруют вторым рабочим раствором
Nа2S2О3, т.е. q(К4[Fе(СN)6]) = q(I2) − q(Nа2S2О3).
Таким образом, данное определение основывается на следующих реакциях:
К4[Fе(СN)6] + I2 = К3[Fе(СN)6] + 2КI + I2
отмерен. остаток
избыток
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
остаток 2-ой раб.р-р
Методика анализа
Полученную задачу разбавляют в мерной колбе до метки дистиллированной водой и тщательно перемешивают. Аликвотную часть задачи пипеткой переносят в колбу для титрования и добавляют из бюретки 10 мл рабочего раствора йода. Так как отмеряют большой объем раствора йода, то необходимо отбирать пробу не спеша, чтобы исключить возможную ошибку натекания. Содержимое колбы перемешивают и помещают в темное место на 5 мин для завершения реакции. Избыток йода титруют рабочим раствором тиосульфата натрия, добавляя крахмал в конце титрования. Титрование заканчивают в момент исчезновения синей окраски. Объем тиосульфата натрия, ушедший на титрование пробы, записывают в рабочую тетрадь. Определение повторяют трижды и рассчитывают среднее значение объема Vср(Na2S2O3), мл. Результаты анализа выражают в граммах содержания К4[Fе(СN)6] в задаче:
V(I2) ∙ N(I2) Vср(Na2S2O3)∙ N(Na2S2O3)
m(К4[Fе(СN)6]) =10 ∙│ − -│∙Мэ(К4[Fе(СN)6])
1000 1000
4. МЕТОДЫ ОСАДИТЕЛЬНОГО ТИТРОВАНИЯ
Методы осадительного титрования основаны на реакциях, сопровождающихся образованием малорастворимых соединений. Они классифицируются в зависимости от применяемого рабочего раствора:
нитрата серебра (АgNО3) − аргентометрия;
нитрат ртути (I) (Нg2(NО3)2) − меркурометрия;
нитрат ртути (II) (Нg(NО3)2) − меркуриметрия;
роданид калия (аммония) КSСN (NН4SСN) − роданометрия.
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
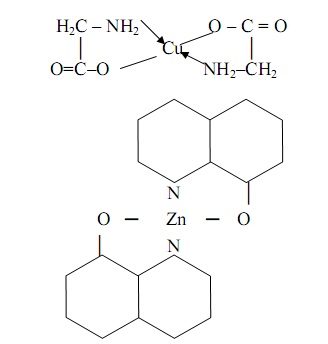
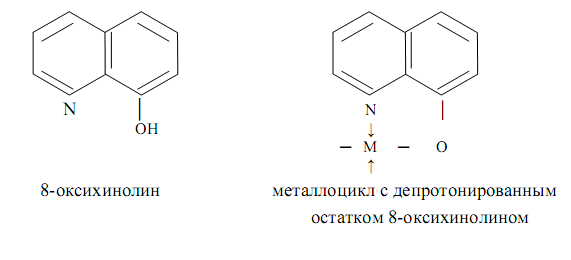
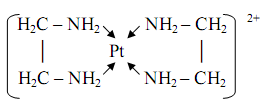
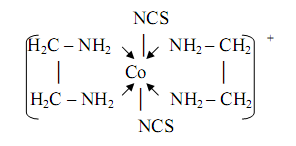
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев