Навигация
Определение точной концентрации раствора хлороводородной кислоты
2.2.2. Определение точной концентрации раствора хлороводородной кислоты
Бюретку заполняют рабочим раствором НСl (см. 1.4). Аликвотную часть раствора буры из мерной колбы переносят пипеткой в коническую колбу для титрования. К раствору добавляют 1 каплю метилового оранжевого и титруют раствором кислоты до перехода окраски индикатора из желтой в оранжевую от одной избыточной капли кислоты. Объем кислоты записывают в рабочую тетрадь (V1, мл). Титрование повторяют трижды и рассчитывают средний объем Vср(НСl), мл, который ушел на титрование аликвотной части навески буры.
По результатам титрования производят расчет точной концентрации приготовленного раствора НСl:
1000 mн(Na2B4O7 · 10H2O)
N(HCl) = --------------------------------------------
10 Mэ(Na2B4O7 10H2O) Vср(НСl)
Рабочий раствор НСl с установленным титром сохраняют для выполнения лабораторных работ.
2.3. Приготовление раствора гидроксида натрия
Приготовить раствор NaOH точно заданной концентрации невозможно, так как NaOH взаимодействует с СО2 и Н2О, содержащимися в воздухе, а потому не отвечает химической формуле. Раствор готовят приблизительной концентрации ~ 0,1н из 1н раствора NaOH путем разбавления.
По закону эквивалентов: qконц.NaOH = qразб.NaOH или
Nконц.NaOH Vконц.NaOH = Nразб.NaOH · Vразб.NaOH
Подставив соответствующие значения концентраций и объема, получим равенство: 1 Vконц.NaOH = 0,1 250, откуда Vконц.NaOH = 25 мл.
Таким образом, для приготовления 250 мл рабочего раствора NaOH в чистую склянку цилиндром отмеряют (250 − 25 = 225 мл) дистиллированной воды и туда же добавляют 25 мл 1н раствора NaOH. Приготовленный раствор плотно закрывают стеклянной притертой пробкой и тщательно перемешивают.
2.4. Стандартизация 0,1н раствора NaOH
В качестве стандартного вещества используют кристаллическую щавелевую кислоту, которую хранят таким образом, чтобы ее состав точно соответствовал химической формуле Н2С2О4 2Н2О.
Титрование основано на реакции:
2NaOH + Н2С2О4 = Na2С2О4 + 2Н2О
оксалат натрия
По реакции соотношение моль реагентов составляет:
n(NaOH) = 2n(Н2С2О4) = n(½H2С2О4), т.е. fэкв(Н2С2О4) = ½.
В точке эквивалентности раствор содержит соль Na2С2О4, которая подвергается гидролизу, и воду. Пренебрегая изменением объема в процессе титрования и учитывая, что рКII щавелевой кислоты 4,19, рассчитывают рН раствора в точке эквивалентности:
рН = 7 + ½ рКII + ½ lg Nсоли = 7 + ½ · 4,19 + ½ ∙ lg 10−1 = 8,595.
Следовательно, для титрования подойдет индикатор фенолфталеин (рТ= 9).
2.4.1. Приготовление раствора щавелевой кислоты
Расчет интервала навески щавелевой кислоты m1 ÷ m2 осуществляют на основании закона эквивалентов: q(Н2С2О4) = q(NaOH) и c учетом аликвотной части кислоты по методике (см. 2.2.1):
mн(Н2С2О4 · 2H2O) N(NaOH) · V(NaOH)
----------------------------- = --------------------------
10 Mэ(Н2С2О4 2H2O) 1000
Рассчитанную навеску взвешивают на аналитических демпферных весах. В мерную колбу со щавелевой кислотой порциями добавляют, обмывая воронку, 30-35 мл дистиллированной воды. Содержимое в колбе перемешивают круговыми движениями до полного растворения всех кристаллов кислоты. Затем раствор в колбе доводят до метки, колбу закрывают пробкой, и раствор тщательно перемешивают.
2.4.2. Определение точной концентрации раствора гидроксида натрия
Бюретку заполняют рабочим раствором NаОН (см. 1.4). Аликвотную часть раствора щавелевой кислоты из мерной колбы пипеткой переносят в коническую колбу для титрования, добавляют 1 каплю фенолфталеина и титруют раствором NаОН (см. 1.6). Титрование заканчивают при появлении бледно-розовой окраски раствора от одной избыточной капли щелочи. Объем раствора, ушедшего на титрование, записывают в рабочую тетрадь (V1, мл). Титрование повторяют трижды и рассчитывают средний объем щелочи Vср(NаОН), мл, который ушел на титрование аликвотной части навески щавелевой кислоты.
По результатам титрования проводят расчет точной концентрации приготовленного рабочего раствора NаОН:
1000 mн(Н2С2O4 · 2H2O)
N(NаОH) = ---------------------------------
10 Mэ(Н2С2O4 · 2H2O) · Vср(NаОН)
Раствор NаОН с установленным титром сохраняют для дальнейшего выполнения лабораторных работ.
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
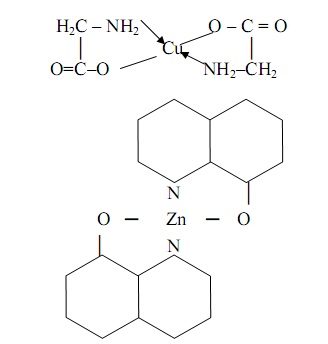
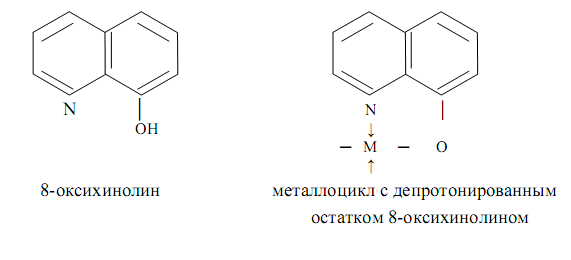
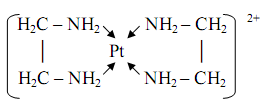
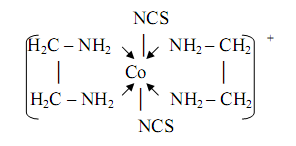
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев