Навигация
Правила работы на рН-метре-милливольтметре
6.4. Правила работы на рН-метре-милливольтметре
В потенциометрическом титровании вместо потенциометров можно использовать рН-метры. рН-метр-милливольтметр типа рН-673М позволяет проводить анализ методом прямого потенциометрического титрования. Шкала прибора отградуирована в единицах рН или мВ и позволяет работать в диапазоне рН −1 ÷ 14 и в диапазоне потенциалов −1400 ÷ 1400 мВ.
Прибор готов к работе через 30 мин после включения в сеть.
Приступая к работе, необходимо тщательно промыть электроды дистиллированной водой, убедиться в правильности сборки электрохими-ческой цепи, а также в том, что электроды надежно закреплены и погружены в растворы, отрегулировать скорость вращения мешалки, чтобы исключить разбрызгивание раствора.
При малом объеме анализируемого раствора в стакан добавляют дистиллированную воду для того, чтобы концы электродов были погружены в раствор.
При отсчете показаний значений рН ориентировочные измерения проводят по нижней шкале прибора в диапазоне −1÷14.
На основании полученного предварительного значения рН точные измерения необходимо проводить в одном из узких диапазонов (−1÷4; 4÷9 или 9÷14), при этом отсчет проводят по верхней шкале.
При измерении потенциалов (+mV или −mV) также сначала ориентировочно оценивают величину потенциала по нижней шкале прибора, а при точном определении показаний по верхней выбранной шкале в соответствующем узком диапазоне, полученные значения умножают на 100.
6.5. Обработка результатов потенциометрического титрования
При проведении потенциометрического титрования по бюретке отмечают объем добавленного рабочего раствора (V, мл), а по шкале потенциометра (рН-метра-милливольтметра) полученные значения рН или потенциал (Е, мВ). Результаты титрования заносят в таблицу1 или 2.
Табл. 1
| № п/п V, мл рН ΔV, мл ΔрН ΔрН/ΔV V', мл |
| 1 2 3 4 5 6 7 |
| 1 0,00 2,06 2 0,20 2,10 0,20 0,04 0,08 0,10 3 0,40 2,15 0,20 0,05 0,10 0,30 4 0,60 2,22 0,20 0,07 0,14 0,50 … |
Табл. 2
| № п/п V, мл Е, мВ ΔV, мл ΔЕ, мВ ΔЕ/ΔV V', мл |
| 1 2 3 4 5 6 7 |
| 1 0,00 −206 2 0,20 −198 0,20 8 26,6 0,10 3 0,40 −188 0,20 10 33,3 0,30 4 0,60 −148 0,20 40 133,3 0,50 … |
В графу 2 таблицы записывают объем добавленного рабочего раствора (V, мл), в графу 3 − установившееся при этом значение рН или Е (мВ). В графы 4-7 записывают результаты обработки первичных экспериментальных данных. В графу 4 − разность объемов титранта между двумя последующими значениями 2-ой графы (шаг титрования); в графу 5 − разность показаний прибора между двумя последующими значениями графы 3; графа 6 − результат деления значения графы 5 на значение графы 4; в графу 7 (V', мл) помещают значения, рассчитанные как среднее арифметическое двух последующих значений графы 2.
Титрование считают законченным, когда после достижения максимальных значений ΔрН или ΔЕ прибавлено еще не менее трех порций рабочего раствора. По данным титрования строят на миллиметровой бумаге две кривые: в координатах "рН − V" или "Е − V" − интегральную кривую; в координатах " ΔрН/ΔV − V' " или " ΔЕ/ΔV − V' " − дифференциальную кривую. По дифференциальной кривой находят значение эквивалентного объема рабочего раствора (Vэкв, мл), которое используют для расчетов результатов анализа (рис.3).
Если в процессе титрования происходит последовательное титрование нескольких ионов (например, галогенидов раствором АgNО3), то на дифференциальной кривой будут наблюдаться несколько максимумов, каждому из которых будет соответствовать свой эквивалентный объем (рис.4). В этом случае предполагается, что титрование каждого последующего иона происходит лишь после полного осаждения предыдущего иона.
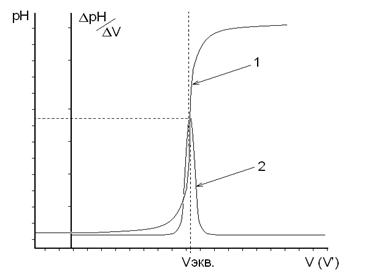
Рис. 3. Графики зависимости рН от объема добавленного титранта.
1 – Интегральная кривая 2 – Дифференциальная кривая
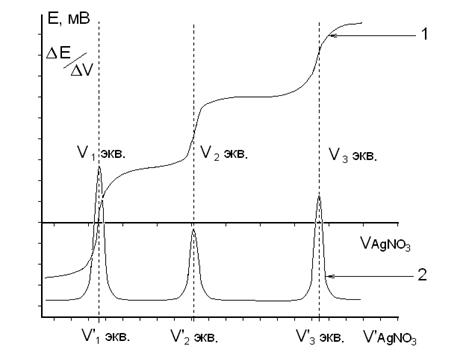
Рис. 4. Графики зависимости электродного потенциала от объема добавленного титранта.
1 – Интегральная кривая 2 – Дифференциальная кривая
ЛИТЕРАТУРА
1. Васильев В.П., Морозова Р.П., Кочергина Л.А. Практикум по аналитической химии. − М.: «Химия», 2000. − 327 с.
2. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. Т.I. − М.: «Химия», 1990. − 479 с.
3. Васильев В.П. Аналитическая химия. Т.I. − М.: «Высшая школа», 1989. − 319 с.
4. Алексеев В.Н. Количественный анализ. − М.: «Химия», 1972. −504 с.
5. Крешков А.П. Основы аналитической химии. Т.2. − М.: «Химия», 1976. − 480 с.
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
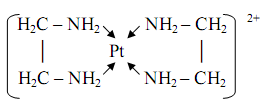
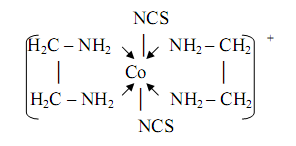
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев