Навигация
Соизмерение мерной колбы и пипетки
1.1.1. Соизмерение мерной колбы и пипетки
Во многих случаях мерной колбой пользуются параллельно с другим измерительным сосудом, например, с пипеткой Мора. Поэтому часто практичнее проверить не абсолютную вместимость мерной колбы, а соответствие объемов колбы и пипетки (произвести их соизмерение). Это важно в тех случаях, когда некоторое количество исследуемого вещества растворено в объеме мерной колбы, а для его определения титрованием пипеткой отбирают лишь аликвотную (кратную) часть раствора (метод пипетирования). Пипетки Мора градуированы по объему вытекающей воды. Для работы в лаборатории используются пипетки на 5 мл. Перед началом работы ее необходимо тщательно промыть, обтереть снаружи насухо и подписать этикеткой со своей фамилией выше метки. Мерная колба рассчитана на объем 50 мл, а значит, в колбу помещается 10 пипеток раствора, причем уровень воды может не совпадать с заводской меткой на колбе.
Для соизмерения из пипетки дозируют 10 порций дистиллированной воды в сухую мерную колбу. При установке мениска глаза наблюдателя должны находиться на уровне метки, нанесенной на пипетке. После внесения десяти порций воды верхний край этикетки, подписанной своей фамилией, прикрепляется на шейке колбы по касательной к нижней части мениска.
Таким образом, после завершения соизмерения отмеренная пипеткой аликвотная часть анализируемого раствора содержит 1/10 часть растворенного в мерной колбе вещества.
1.2. Приготовление раствора в мерной колбе и отбор аликвотной части
В мерную колбу переносят навеску стандартного вещества и добавляют примерно до половины объема дистиллированной воды. Частицы твердого вещества полностью растворяют, и объем воды доводят до метки.
Раствор тщательно перемешивают, закрыв колбу пробкой и переворачивая ее на 180º не менее 10 раз. Раствор перемешивают всплывающим воздушным пузырьком.
Чистую пипетку, обтертую снаружи фильтровальной бумагой насухо, промывают приготовленным в мерной колбе раствором, который затем сливают в отходы. Промыв пипетку, дозируют порцию раствора в колбу для титрования, пользуясь теми же приемами, что и при соизмерении. Наполняя пипетку, нужно следить за тем, чтобы ее конец находился в жидкости (лучше опускать пипетку до дна колбы).
1.3. Приготовление титрованных растворов
По способу приготовления рабочие растворы делятся на растворы с приготовленным титром и растворы с установленным титром.
Для получения раствора с приготовленным титром взвешивают точную навеску стандартного вещества, количественно переносят ее в мерную колбу, растворяют в дистиллированной воде, доводят до метки, тщательно перемешивают и рассчитывают титр приготовленного раствора:
mн
Т = ------- , где
Vк
mн − масса навески стандартного вещества, г;
Vк − объем мерной колбы, мл.
Рабочие растворы многих веществ нельзя приготовить по точной навеске, так как они содержат примеси. Поэтому растворы таких веществ готовят приблизительной концентрации, а затем их точную концентрацию устанавливают в процессе титрования навески стандартного вещества. Концентрацию таких растворов рассчитывают по закону эквивалентов:
mн(А) · 1000
= N*(В) · V(В)
Мэ(А)
1.4. Подготовка бюретки.
Перед титрованием бюретку промывают дистиллированной водой, а затем дважды новыми порциями стандартного (рабочего) раствора. При заполнении бюретки рабочим раствором в третий раз носик бюретки заполняют раствором. Для этого носик задирают кверху, и зажим бюретки медленно отпускают. Раствор плавно вытесняет воздух из носика бюретки. Уровень раствора устанавливают на нулевой отметке. При этом глаза наблюдателя должны находиться на уровне мениска, чтобы не возникала погрешность из-за неправильного угла зрения. Если раствор бесцветен или бледно окрашен, уровень измеряют по нижнему темному краю вогнутого мениска, который четко виден на фоне освещенного листка белой бумаги. Уровень установлен правильно, если метка имеет вид прямой, касательной к нижнему темному краю мениска. При работе с темно окрашенными или непрозрачными растворами уровень измеряют по верхнему «ровному» краю мениска, который должен совпадать с нулевой отметкой.
По окончании титрования бюретку промывают и наполняют дистиллированной водой.
1.5. Взятие навески
На столе возле аналитических весов должен находиться рабочий журнал, ручка для записей, фарфоровый тигель для взвешивания, мерная колба и разновесы. Пустой, чистый тигель ставят на левую чашку весов и определяют его точный вес (mт). Затем массу на левой чашке весов увеличивают на желаемую величину навески и всыпают в тигель столько вещества, чтобы равновесие устанавливалось в пределах положительной части шкалы, наблюдаемой на светящемся экране весов. Массу тигля с навеской записывают в рабочий журнал (mт+н). Вещество из тигля количественно переносят в мерную колбу через сухую воронку, тигель вновь взвешивают и результат записывают в рабочий журнал (mт+о). Потери вещества при пересыпании в мерную колбу недопустимы.
Массу навески перенесенную в мерную колбу, вычисляют по разности двух взвешиваний: mн = mт+н − mт+о.
Похожие работы
... химия не только обеспечила эти области эффективными методами анализа, но и послужила основой разработки многих новых технологических процессов. Основные этапы развития аналитической химии Многие практические приемы аналитической химии и аналитические методики были известны в глубокой древности. Это, прежде всего пробирное искусство, или пробирный анализ, который выполнялся «сухим» путем, т. ...
... соответствует знак (+) на пересечении строки 8 и столбца Ж. Можно дать и более подробную характеристику межпредметных связей - на уровне подразделов и примеров, а также перечни методов и понятий, но в настоящей статье такие детали вряд ли целесообразны. В таблице цифрами обозначены следующие разделы курса АХ: 1 - метрологические основы химического анализа; 2 - теория и практика пробоотбора; 3 - ...
... АНАЛИЗА 4.1. Теории кислотно-основных индикаторов Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ...
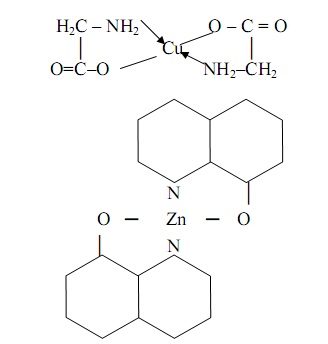
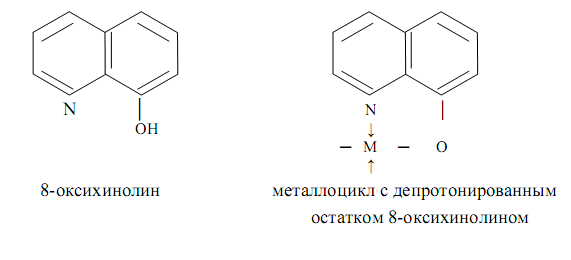
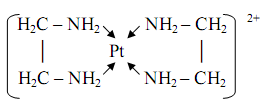
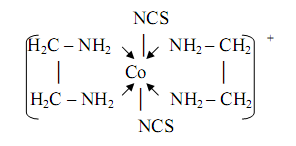
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
0 комментариев