Навигация
Ковалентная (неполярная, полярная) связь. Механизмы образования ковалентной связи
4. Ковалентная (неполярная, полярная) связь. Механизмы образования ковалентной связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Химическая связь – взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. Атом на внешнем энергетическом уровне способен содержать от одного до восьми электронов. Валентные электроны – электроны предвнешнего, внешнего электронных слоев, участвующие в химической связи. Валентность – свойство атомов элемента образовывать химическую связь.
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Общая электронная пара осуществляется через обменный или донорно-акцепторный механизм. Обменный механизм образования ковалентной связи – спаривание двух неспа-ренных электронов, принадлежащих различным атомам. Донорно-акцепторный механизм образования ковалетной связи – образование связи за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Есть две основные разновидности ковалентной связи: неполярная и полярная.
Ковалентная неполярная связь возникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
Ковалентная полярная связь возникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью.
Чем сильнее перекрываются электронные облака, тем прочнее ковалентная связь.
Электроотрицательность – способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Свойства ковалентной связи: 1) энергия; 2) длина; 3) насыщаемость; 4) направленность.
Длина связи – расстояние между ядрами атомов, образующих связь.
Энергия связи – количество энергии, необходимое для разрыва связи.
Насыщаемость – способность атомов образовывать определенное число ковалентных связей.
Направленность ковалентной связи – параметр, определяющий пространственную структуру молекул, их геометрию, форму.
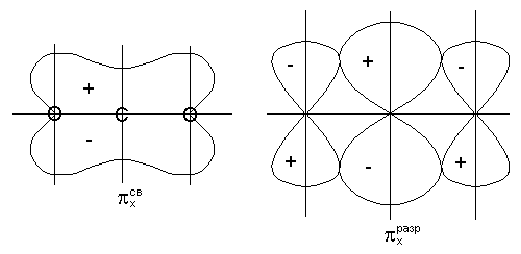
Гибридизация – выравнивание орбиталей по форме и энергии. Существует несколько форм перекрывания электронных облаков с образованием ?-связей и ?-связей (?-связь намного прочнее ?-связи, ?-связь может быть только с ?-связью). Ковалентная связь - это связь, возникающая между атомами за счет образования общих электронных пар. В основе ее также лежит представление о приобретении атомами энергетически выгодной и устойчивой электронной конфигурации из 8 электронов (для атома водорода из 2). Такую конфигурацию атомы получают не путем отдачи или присоединения электронов как в ионной связи, а посредством образования общих электронных пар. Механизм образования такой связи может быть обменный или донорно-акцепторный.
К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например водород: Н2 Н. +Н. →Н:Н или Н-Н. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s –электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. По этому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы Сl2. При образовании молекулы N2 Образуются 3 общие электронные пары. Перекрываются р-орбитали. Связь называется неполярная.
При образовании молекулы хлороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона хлора Н-Сl. Связывающая электронная пара смещена к атому хлора, в результате чего образуется диполь, который измеряется дипольным моментом. Связь называется полярная.
По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны.
Ковалентные связи классифицируют не только по механизму образования общих электронных пар, соединяющих атомы, но и по способу перекрывания электронных орбиталей, по числу общих пар, а также по смещению их. По способу перекрывания – у (сигма s- s, s-р, р-р) р (р-р гантели перекрываются двумя местами). В молекуле азота между атомами существуют одна у-связь и две р-связи, которые находятся в двух взаимно перпендикулярных плоскостях.
По числу общих электронных пар различают: одинарные Н2, НСl; двойные С2Н4, СО2; тройные N2.
По степени смещенности: полярные и неполярные. Связь между атомами с одинаковой электроотрицательностью – неполярная, с разной – полярная.
Исследования ученых позволили сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами. Каждый электрон занимает место в квантовых ячейках обоих атомов, т.е. движется в силовом поле, образованном двумя силовыми центрами – ядрами атомов водорода. Это представление о механизме образования химической связи было развито учеными Гейтлером и Лондоном на примере водорода.это было распространено и на более сложные молекулы. Разработанная на этой основе теория образования химической связи получила название метода валентных связей. Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул – все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значение до настоящего времени. В основе метода ВС лежат следующие положения:
- ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
-ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
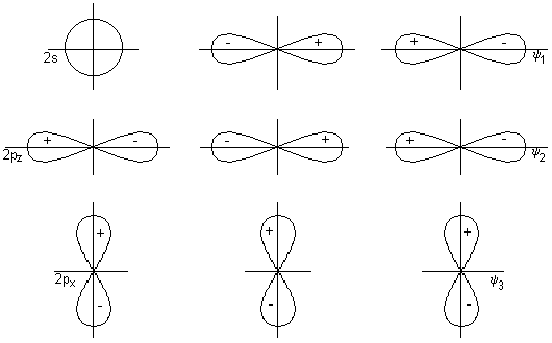
Геометрическая форма s –орбитали сферическая, от центра к краям размазанная (более плотная у ядра, и менее- на краях). Орбитали р-электронов представляют собой гантели, направленные вдоль осей координат. Облака d –электронов имеют более сложную форму. Метод гибридизации орбиталей исходит из предположения, что при образовании молекул вместо исходных s-, р-, d-,f- орбиталей (облаков) образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается более полное их перекрывание с электронными облаками других атомов. На гибридизацию затрачивается энергия, за то она окупается более полным перекрыванием. Получается более прочная молекула. Затраченная на гибридизацию энергия окупается энергией, выделяющейся при образовании связи. Пример –молекула метана.В результате перекрывания четырех гибридных sр3 орбиталей атома углерода и 4 s орбиталей 4-х атомов водорода, образуется тетраэдрическая модель молекулы метана с четырьмя у связями, под углом 1090. Если в молекуле гибридизуется 3-р орбитали, то sр2 гибридизация – молекула этилена, если 2 орбитали sр – гибридизция (ацетилен). У элементов 3 и последующих периодов в образовании гибридных облаков участвуют и d-электроны. В этом случае образуются 6 равноценных гибридных облака, вытянутых к вершинам октаэдра sр3 d2-гибридизация. Такую гибридизацию имеет центральный атом комплексного иона. Этим объясняется их октаэдрическая структура.
Ковалентная связь обладает направленностью. Область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам.
Характер распределения электронов по молекулярным орбиталям позволяет объяснить магнитные свойства частиц. Молекулы, суммарный спин которых равен нулю, проявляют диамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются против направления поля. Молекулы, суммарный спин которых отличен от нуля, проявляют парамагнитные свойства, т.е. во внешнем магнитном поле их собственные магнитные моменты ориентируются в направлении поля. Таким образом молекула Н2 диамагнитна.
Геометрическая форма молекул зависит от направленности химической связи. Ядра атомов молекул имеющих sр-гибридизацию атомных орбиталей расположены в одной плоскости, sр2 –направлены к вершинам треугольника, sр3 – к верщинам тетраэдра
Понятия о методах валентных связей и молекулярных орбиталей образования химических соединений
Химическая связь, осуществляемая за счет образования общих (связывающих) электронных пар, называется ковалентной.Для объяснения ковалентной связи используют 2 метода квантово-механического расчета: метод валентных связей (МВС) метод молекулярных орбиталей (ММО)
Похожие работы
... подкрепляет своим одобрением неправильный или не вполне точный ответ ученика. 1.2 Совершенствование школьного химического эксперимента при проблемном обучении 1.2.1 Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения Характерной особенностью развивающего обучения является широкое использование проблемного подхода, который включает создание ...
ависимо от способа получения и места нахождения. 2. Строение внешнего электронного уровня атома калия и кальция. 1 правило Клечковского. Строение внешнего электронного уровня атома скандия. 2правило Клечковского У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... учреждение страны, а в ее задачи входило усовершенствование наук, просвещение, а также усовершенствование мануфактур, ремесел и фабрик. В то же время в начале XIX столетия, особенно после Отечественной войны 1812 г., в развитии химии в России появились новые черты. Смена мануфактурного производства фабрично-заводским выдвинула перед учеными множество практических задач, связанных с рациональной ...
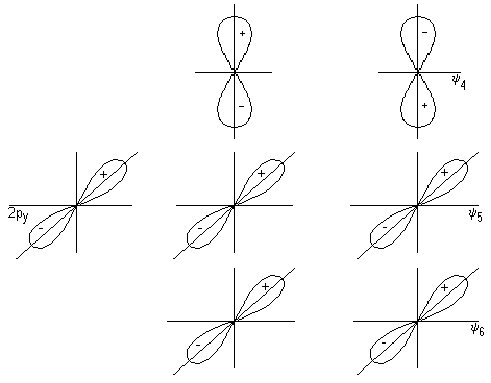
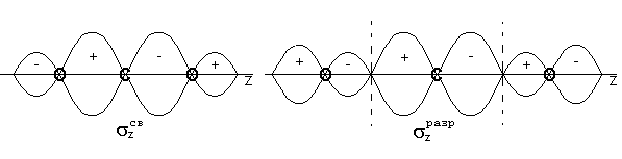
0 комментариев