Навигация
Окислитель или восстановитель иногда дополнительно расходуется на связывание получающихся продуктов (солеобразование).Например, в реакции
2. Окислитель или восстановитель иногда дополнительно расходуется на связывание получающихся продуктов (солеобразование).Например, в реакции
Cu + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
на окисление на связывание на 3 атома восстановителя Сu0 требуется для окисления 2 молекулы окислителя HNO3; кроме того, на образование нитрата меди - трех молекул - требуется еще 6 молекул HNO3 для связывания трех атомов меди. Таким образом, общий расход азотной кислоты: 2 молекулы на окисление плюс 6 молекул на связывание (солеобразование), то есть всего 8 молекул HNO3. И окончательно уравнение примет вид:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
З. Если в реакции число элементов, изменяющих свою степень окисления, больше двух, то устанавливают общее число электронов, отдаваемых восстановителями, и общее число электронов, присоединяемых окислителями, а в остальном соблюдается общий порядок составления уравнения реакции. Например,
3As3+2S2-3 + 28HN5+O3 + 4H2O ® 6H3As5+O4 + 9H2S6+O4 + 28N2+O
![]()
![]() 2As3+
- 4e ®
2As5+ -28e 3
2As3+
- 4e ®
2As5+ -28e 3
![]() 3S2-
- 24 ®
3S6+
3S2-
- 24 ®
3S6+
N5+ + 3e ® N2+ +3e 28
4. Оба элемента – и окислитель, и восстановитель – находятся в одной и той же молекуле. Это реакция внутримолекулярного окисления-восстановления и реакции диспропорционирования. Для удобства подбора коэффициентов в этом случае иногда можно рассматривать процесс как бы идущим справа налево. Например,
3HN3+O2 ® HN5+O3 + 2 N2+O + H2O
![]() N3+
+ e ®
N2+ 2
N3+
+ e ®
N2+ 2
N3+ - 2e ® N5+ 1
Продукты окислительно-восстановительных реакций устанавливаются опытным путём

Элементы, имеющие высшую степень окисления, могут быть только окислителями.
Элементы, имеющие низшую степень окисления, могут быть только восстановителями.
Элементы, находящиеся в промежуточной степени окисления, могут и окисляться, и
восстанавливаться, то есть проявляют окислительно-восстановительную двойственностьТипичные окислители: металлы, соединения неметаллов в низшей степени окисленияТипичные восстановители: галогены, О2, N2, вещества, содержащие элемент в высшей СО.
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат- иона MnO4
Классификация ОВР
1. К межмолекулярным относятся реакции, у которых окислитель и восстановитель находятся в разных веществах.
2. К внутримолекулярным относятся реакции, которые протекают с изменением степени окисления атомов в одной и той же молекуле.
3. К реакциям диспропорционирования, или дисмутации (самоокисления-самовосстановления), относятся реакции, сопровождающиеся одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента.
Эти реакции характерны для веществ, содержащих атомы с промежуточной степенью окисления
30. Электрохимические процессы. Гальванический элемент. ЭДС гальванического элемента и его измерение
Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn2+ // Cu2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zno ––> Zn2+ + 2е-
Сu2+ + 2е- ––> Сuo
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом. При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu2+ + Zno ––> Сuo + Zn2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ДЦ и количеством прошедшего по цепи электричества q:
![]() (III.39)
(III.39)
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента.
Электрохимические процессы, как и окислительно-восстановительные реакции (ОВР), связаны с изменением степени окисления веществ, участвующих в реакции. Основное отличие ОВР от электрохимических процессов заключается в том, что процессы восстановления и окисления пространственно разделены и перенос электронов может быть зафиксирован как некоторый ток (в гальваническом элементе, при коррозии) или, наоборот, электрохимический процесс может происходить за счет внешнего источника тока (электролиз).
В любом случае для протекания электрохимической реакции необходима электрохимическая цепь, существенными компонентами которой являются электроды и электролит (водный или неводный).
Под электродами обычно понимают или собственно некий проводник или систему, состоящую из проводника, погруженного в раствор электролита. При контакте металлического проводника с раствором электролита на его поверхности возникает некий заряд, за счет переноса электронов, что приводит к возникновению разности электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Эта разность называется электродным потенциалом.Абсолютную величину электродного потенциала отдельного электрода измерить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения, т.е. составляют электрохимическую цепь. В качестве электродов сравнения для водных сред используют хлорсеребряный или обратимый водородный электрод сравнения. Последний представляет собой платинированную (электрохимическим способом осажденную на платиновую пластину) платину, погруженную в раствор кислоты (серной, соляной) с активностью ионов водорода равной 1, через который продувают водород при давлении 101кПа. В системе устанавливается равновесие
H2(г) H2(Pt) 2H(Pt) 2H+ +2e(Pt)
Потенциал этого равновесия в указанных условиях принят равным нулю при любых температурах.
Табличные значения стандартных электродных потенциалов (Eo) приведены относительно обратимого водородного электрода. Эти значения нормированы на один электрон и их относят к процессу восстановления: Ox + ne =Red
В практических работах в качестве электрода сравнения чаще, чем водородный, используют хлорсеребряный электрод. Хлорсеребряный электрод представляет собой серебряную проволоку, электролитически покрытую AgCl, помещенную в насыщенный раствор KCl.
Стандартные электродные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют ряд стандартных электродных потенциалов металлов, или электрохимический ряд напряжений металлов. Ряд электродных потенциалов дает полезные знания:
1.Металлы, имеющие значения электродного потенциала меньше, чем у водорода, могут растворяться с выделением водорода в кислотах, анионы которых не являются окислителями.
2.Металлы, имеющие большее, чем у водорода, значение стандартного электродного потенциала могут встречаться в природе в самородном виде.
3.Металлы, имеющие меньшее значение электродного потенциала могут вытеснять металлы с большим значением электродного потенциала из растворов их солей.
4.Металлы, имеющие электродный потенциал меньше, чем потенциал реакции
2H2O + 2e = H2 + 2OH- Eo = –0,83В
в стандартных условиях могут растворяться в воде с выделением водорода.
Под гальваническим элементом понимают единичные ячейки химических источников тока, предназначенных для однократного электрического разряда. Гальванический элемент представляет собой два электрода различной природы и электролит. Максимальная разность потенциалов этих электродов в отсутствие электрического тока называется электродвижущей силой (э.д.с.) гальванического элемента. Э.д.с. может быть рассчитана как разность равновесных потенциалов этих электродов.
Для гальванического элемента, составленного из железного и медного электродов э.д.с. будет равна:
Fe 2+ + 2e =Fe Eo= –0,44
Cu 2+ +2e=Cu Eo=+0,34
э.д.с. =+ 0,34 – ( –0,44) =0,77В,. Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода еэ называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
![]() (III.40)
(III.40)
В уравнении Нернста е° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина е° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля-Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
![]() (III.41)
(III.41)
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.44)
(III.44)
![]() (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля-Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
![]() (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu2+] < [Zn2+] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ек = еа) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
![]() (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Стандартный (нормальный) водородный электрод. Стандартный электродный потенциал. Таблицы стандартных окислительно-восстановительных потенциалов
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или EO, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой как гальваническая ячейка всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту. Вычисление стандартных электродных потенциалов
Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из "пары" электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен стандартный водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки - и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.
Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность.
Например:
(ур-е 1) Fe3+ + 3e− --> Fe(тв) -0.036 В
(ур-е 2) Fe2+ + 2e− --> Fe(тв) -0.44 В
Для получения третьего уравнения:
(ур-е 3) Fe3+ + e− --> Fe2+ (+0.77 В)
следует умножить потенциал первого ур-я на 3, перевернуть ур-е 2 (поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал ур-я 3.
Таблица стандартных электродных потенциалов
Основная статья: Таблица стандартных электродных потенциалов
Чем больше стандартные восстановительные потенциалы, тем легче их можно восстановить, другими словами, тем более сильными окислителями они являются. И наоборот: большой отрицательный потенциал означает, что данная форма является сильным восстановителем. Например, F2 имеет 2,87 В, а Li+ имеет -3,05 В, фтор - окислитель, литий - восстановитель. Таким образом, Zn2+, стандартный восстановительный потенциал которого равен -0,76 В, может быть окислен любым другим электродом, стандартный потенциал которого больше -0,76 В. (напр., H+(0 В), Cu2+(0,16 В), F2(2,87 В)) и может быть восстановлен любым электродом, стандартный потенциал которого меньше -0,76 В (напр., H−(-2,23 В), Na+(-2,71 В), Li+(-3,05 В)).В гальванической ячейке, где самопроизвольная окислительно-восстановительная реакция заставляет ячейку производить электрический потенциал, Энергия Гиббса ДGo должна быть отрицательной, в соответствии со следующим уравнением:
ДGoяч = -nFEoяч
где n это количество молей электронов на моль продуктов, а F является постоянной Фарадея, ~96485 Кл/моль. Таким образом применимы следующие правила:
если Eoяч> 0, тогда процесс самопроизвольный (гальваническая ячейка)
если Eoяч< 0, тогда процесс несамопроизвольный (электролитическая ячейка)
Нестандартные условия
Стандартные электродные потенциалы даны при стандартных условиях. Однако, реальные ячейки могут действовать и при нестандартных условиях. При данном стандартном потенциале, потенциал при нестандартных эффективных концентрациях может быть вычислен с использованием уравнения Нернста:
Величины E0 зависят от температуры (кроме стандартного водородного электрода) и обычно относятся к стандартному водородному электроду при этой температуре. Для конденсированных фаз, величины потенциалов также зависят от давления.
Потенциал. Из курса физики известно, что электрический потенциал- работа по перемещению единичного положительного заряда из - данной точки пространства в бесконечность. Каждый электрод обладает каким-то электрическим потенциалом. Абсолютное значение потенциала электрода определить нельзя. Можно лишь сравнивать потенциалы различных электродов друг с другом. Для этого надо два электрода объединить в электрохимическую цепь. Для этого металлические части соединяются проводником, а растворы электролитов, в которые они погружены-стеклянной трубкой, заполненной раствором электролита (обычно хлорида калия). Эту трубку называют электролитическим ключом или солевым мостиком. Она обеспечивает ионную проводимость между растврами. Таким образом возникает замкнутая цепь или гальванический элемент, который показан на рис. 3.
Разность электрических потенциалов двух электродов в такой цепи называют электродвижущей силой силой цепи ЭДС(Рис. 4. Электрохимическая цепь со стандартным водородным электродом: -стандартный водородный электрод, 2-исследуемый электрод, 3 - электролитический ключ). Значение ЭДС может быть измерено, что позволяет сравнивать потенциалы электродов друг с другом. Обычно в качестве электрода, относительно которого определяют потенциалы всех систем, используют стандартный водородный электрод. Его потенциал условно принимают равным нулю.
Таким образом., электродным потенциалом называют ЭДС электрохимической цепи-гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода. Такая цепь изображена на рис. 4. Электродный потенциал обычно обозначают буквой Е.
Электрод, относительно которого производится измерение потенциала, называется электродом сравнения. Кроме водородного, в качестве электродов сравнения используют хлорсеребряный,каломельный и некоторые другие. Во всех случаях потенциал электрода сравнения принимается равным нулю. Можно перейти от одной шкалы потенциалов к другой. Например стандартный потенциал цинкового электрода по водородной шкале равен — 0,76 В, а потенциал хлорсеребряного электрода + 0,22 В (по той же шкале). Следовательно, потенциал цинкового электрода по шкале хлорсеребряного электрода будет равен: — 0,76 — 0,22 = 0,98 В. Измерение электродных потенциалов.
Точно измерить электродный потенциал достаточно трудно, так как необходимо, чтобы в процессе измерения не нарушалось равновесие на электродах. По этой причине невозможно получить точное значение Е с помощью обычного вольтметра: если мы замкнем цепь, используя вместо проводника вольтметр, то в ней начнет протекать довольно большой ток, который нарушит равновесие на электродах. Для измерения можно использовать специальные вольтметры с высоким входным сопротивлением (более 1012 Ом). При включении в цепь такого прибора протекающий ток слишком мал для оказания существенного влияния на электродное равновесие.
Стандартный электродный потенциал-это потенциал электрода при стандартных условиях, его обозначают символом Е°. Эти потенциалы определены для многих окислительно-восстановительных систем и обычно приводятся в химических справочниках. Если электроды (на пример, металлические электроды 1-го рода) расположить в порядке возрастания потенциала, то мы получим таблицу, называемую рядом стандартных электродных потенциалов. Этот ряд часто называют рядом напряжений, однако этот термин устарел и его лучше не использовать.

При помощи ряда стандартных электродных потенциалов можно характеризовать некоторые химические свойства металлов. Например, его применяют для выяснения, в какой последовательности восстанавливаются ионы металлов при электролизе, а также при описании других свойств металлов.
Чем меньше алгебраическая величина потенциала, тем выше восстановительная способностьэтого металла и тем ниже окислительная способность его ионов. Как следует из этого ряда, металлический литий - самый сильный восстановитель, а золото-самый слабый. И наоборот, ион золота Аu3+-самый сильный окислитель, а ион лития Li+ -самый слабый.
Каждый металл в ряду стандартных электродных потенциалов обладает способностью вытеснять все следующие за ним металлы из растворов их солей. Однако это не означает, что вытеснение обязательно происходит во всех случаях. Например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuS04. Это объясняется тем, что хлорид-ион Сl- быстро разрушает защитную поверхностную пленку на алюминии, а сульфат-ион SO4 2-практически не разрушает ее.
Все металлы, имеющие отрицательные значения стандартных электродных потенциалов, т.е. стоящие в ряду до водорода, вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (например, из НСl или разбавленной H2S04) и растворяются в них. Однако есть и исключения. Например, свинец практически не растворяется в серной кислоте. Это обусловлено образованием на поверхности металла защитной пленки труднорастворимого сульфата свинца PbS04, который затрудняет контакт металла с раствором кислоты. Поэтому можно сделать вывод, что пользоваться рядом стандартных электродных потенциалов следует с учетом всех особенностей рассматриваемых процессов.
Стандартные потенциалы окислительно-восстановительных реакций. Возможность протекания любой окислительно-восстановительной реакции в реальных условиях обусловлена рядом причин: температурой, природой окислителя и восстановителя, кислотностью среды, концентрацией веществ, участвующих в реакции, и т. д. Учесть все эти факторы бывает трудно, но, помня о том, что любая окислительно-восстановительная реакция протекает с переносом электронов от восстановителя к окислителю, можно установить критерий возможности протекания такой реакции.
Количественной характеристикой окислительно-восстановительных процессов являются нормальные окислительно-восстановительные потенциалы окислителей и восстановителей (или стандартные потенциалы электродов).
Чтобы понять физико-химический смысл таких потенциалов, необходимо проанализировать так называемые электрохимические процессы.
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
Чтобы понять природу электрохимических процессов, обратимся к рассмотрению нескольких достаточно простых ситуаций. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы.
Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец, наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, которое можно выразить уравнением:
![]()
или с учетом гидратации ионов в растворе:
![]()
Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления.
При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом Ле Шателье смещается влево и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде.
Равновесие можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионов из раствора.
При погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой окислительно-восстановительной способности металла в виде твердой фазы.
У изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл - раствор. Такие пары называют полуэлементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С.
Ряд стандартных электродных потенциалов. Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25 °С, и характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е°.
Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-”, а знак “+” имеют стандартные потенциалы электродов, являющихся окислителями.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов: Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напряжений характеризует химические свойства металлов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в электрохимическом ряду напряжений металлов после него.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т. е. находящиеся в электрохимическом ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Как и в случае определения значения Е° металлов, значения Е° неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений
стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция?
Количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
ВОДОРОДНЫЙ электрод в электрохимии - обычно платинированная пластина, погруженная в раствор кислоты с определенной концентрацией ионов Н+ и омываемая газообразным водородом. При давлении водорода 0,1 МПa и термодинамической активности его ионов, равной единице, потенциал водородного электрода условно принят равным нулю. Такой водородный электрод называется стандартным, он служит электродом сравнения, от которого отсчитывают потенциалы других электродов.
32 Термодинамика протекания электродных процессов. Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС гальванического элемента с энергией Гиббса. Связь ЭДС с константой равновесия
Любые химические реакции связаны с перемещением электронов, поэтому могут быть использованы для получения электрического тока. При этом источником электрической энергии является энергия, освобождающаяся при химической реакции. Такое превращение энергии химической реакции в электрическую возможно лишь при помощи специального устройства, называемого гальваническим элементом. Оно позволяет направлять поток электронов по металлическим проводникам.
Простое сжигание водорода сопровождается большим выделением тепла. Если его провести при постоянном объеме, например, в калориметрической бомбе, то ДU = -284,5 кДж/моль. Если эту же реакцию осуществить в гальваническом элементе электрохимическим путем, то часть этой убыли внутренней энергии может быть использована для получения электрического тока. Схема такого гальванического элемента показана на рис: IX.1. В водный раствор (например, NaOH) погружены два платиновых электрода. Левый электрод омывается пузырьками водорода, а правый - кислородом. Водород в левой части этого гальванического элемента растворяется в платине и ионизируется. Вследствие большого сродства к молекулам воды некоторое количество протонов переходит в слой раствора, непосредственно прилегающий к электроду. При этом образуются ионы гидроксония Н3О+ - они обозначены плюсами в правой части рис. IX. 1, а электроны (минусы) остаются на поверхности платинового электрода. Из-за электростатического притяжения между электронами и ионами гидроксония последние остаются вблизи электрода и не уходят в объем раствора. Благодаря этому на границе металл-раствор возникает так называемый двойной электрический слой, подобный двум обкладкам конденсатора. На поверхности правого электрода происходит реакция образования ионов гидроксила:
3/2O2г + H2Oж + 2e = 2OH-
в результате которой из металла удаляются два электрона. Поверхность металла поэтому заряжается положительно и на ней также образуется двойной электрический слой, но противоположного знака. Если соединить левый и правый электроды металлическим проводником, то по нему потечет электрический ток. Стрелка на рис. IX.1 указывает направление потока электронов. Разность электрических потенциалов на электродах разомкнутого гальванического элемента называется его электродвижущей силой (э. д. с.).
Очевидно поток электронов, возникающий в элементе может быть использован для производства работы, например, для вращения электрического мотора. Протекание тока приводит к уменьшению зарядов двойных электрических слоев. Поэтому ионы Н3О+ и ОН- получают возможность удаляться от электродов и образовывать в растворе нейтральные молекулы воды. Одновременно вследствие реакций на электродах вновь восстанавливаются двойные слои. Происходящие на электродах и в растворе изменения отражаются следующими уравнениями:
H2г = 2H+ + 2e;
3/2 O2г + H2Oж + 2e = 2OH-;
2H+ + 2OH- = 2H2Oж,
сумма которых представляет собой реакцию образования воды:
H2г + 1/2O2г = H2Oж,
Таким образом, одну и ту же реакцию образования воды из элементов можно осуществить двумя различными способами. Какой из этих способов выгоднее с точки зрения превращения энергии химической реакции в работу? В первом способе при сжигании водорода в калориметрической бомбе (V = const) при 298 К уменьшение внутренней энергии равно количеству выделившегося тепла -ДU = 284,5 кДж/моль, а работа равна нулю.
Во втором случае часть этого изменения внутренней энергии (ДG) может быть превращена в электрическую работу. Если реакция в гальваническом элементе проводится обратимо, то сопровождающая ее убыль энергии Гиббса полностью идет на производство электрической работы.
В рассматриваемом случае ДG0 = -237,2 кДж/моль и, следовательно, только ∼47 кДж/моль переходит в тепло. Этот пример показывает, что вообще энергию, освобождающуюся при горении природных видов топлива, выгоднее непосредственно преобразовывать в электрическую, так как к. п. д. тепловых машин и тепловых электростанций невелик. Описанный водородно-кислородный элемент является примером так называемых топливных элементов.
Работы по созданию таких элементов получили в последнее время широкое развитие в связи с новыми задачами техники. В этих элементах топливо и окислитель должны храниться отдельно и подаваться к электродам, на которых осуществляются электрохимические реакции. При этом элемент может работать непрерывно, если к нему подводятся реагенты и отводятся продукты реакции, что особенно удобно при использовании жидких и газообразных веществ. Вместо сжигания угля возможно использовать реакцию Ст + О2г = СО2г для получения электрического тока.
Очевидно, что в реальных условиях гальванические элементы работают необратимо, поэтому в работу превращается лишь часть изменения энергии Гиббса реакции, протекающей в элементе. Повторим, что гальванический элемент может работать при условии протекания в нем самопроизвольной химической реакции или какого-либо другого самопроизвольного процесса, сопровождающегося убылью энергии Гиббса.
Если к рассматриваемому гальваническому элементу приложить извне достаточно большую разность потенциалов, превышающую его э. д. с. и имеющую противоположное направление, то будет происходить разложение воды с выделением водорода и кислорода. Таким образом, процессы получения электрического тока в гальванических элементах и электролиза взаимно противоположны.
Особенностью электрохимического процесса в гальваническом элементе является важная для теории возможность его осуществления в условиях весьма близких к обратимости. Это достигается благодаря потенциометрическому методу, в котором э. д. с. изучаемого гальванического элемента практически полностью компенсируется с помощью противоположно направленной э.д. с. внешнего источника. Такой прием позволяет измерять э.д.с. при отсутствии тока в цепи, т.е. когда элемент не работает, а его э.д.с. максимальна. Контроль за отсутствием тока проводят гальванометрами (нуль-инструментами) высокой чувствительности. Они дают отклонение при прохождении тока силой 10-8 - 10-9 А. Такой слабый ток при прохождении через электролит даже в течение многих лет не смог бы выделить сколько-нибудь заметных количеств вещества.
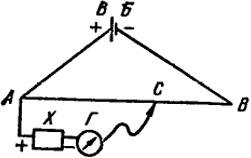
Рис. IX.2. Схема измерения э.д.с. методом компенсации.
Принципиальная схема измерения э. д. с. гальванического элемента компенсационным методом показана на рис. IX.2. Постоянный ток от вспомогательной батареи ВБ подается на концы реохорда АВ - проволоки с постоянным сечением. Поэтому падение напряжения вдоль реохорда пропорционально длине соответствующего отрезка на прямой АВ. С помощью подвижного контакта С можно отбирать произвольную часть падения напряжения между точками А и В. Из рис. IX.2 видно, что напряжение, снимаемое с любого участка реохорда, например АС, направлено навстречу э. д. с. элемента X.
Передвигая контакт С по реохорду, находят такое положение, при котором нуль-гальванометр Г указывает отсутствие тока в цепи АХГС. Это означает, что падение потенциала от ВБ на отрезке АС полностью компенсирует э. д. с. элемента X.
Если э. д. с. вспомогательной батареи ВБ равна ЕБ, то э. д. с. элемента X ЕX определяется из пропорции:
ЕХ/ЕБ = АС/АВ, откуда ЕX = (АС/АВ) ЕБ.
Для того, чтобы откалибровать вспомогательную батарею перед измерениями ЕX, вместо элемента X включают другой, э. д. с. которого точно известна, например стандартный элемент Вестона. Устройство этого элемента будет описано ниже.
Повторим, что определяемая таким образом э. д. с. максимальна, так как при измерении отсутствует падение потенциала как вне, так и внутри элемента. Работа, совершаемая элементом с ничтожно малым током при обратимом проведении процесса была бы максимальной.
Теоретический и практический интерес представляют гальванические элементы с металлическими электродами. Рассмотрим, например, реакцию Znт + CuSО4водн. р-р. = ZnSО4водн. р-р + Cuт или Znт + Cu2+ = Zn+2 + +Cuт, которая может быть осуществлена двумя путями. Один из них является полностью необратимым. Цинковую пластинку помещают в водный раствор медного купороса, при этом происходит выделение металлической меди и растворение цинка. Электроны переходят от цинка непосредственно к меди, и реакция протекает без производства работы, а сопровождается только выделением тепла. В случае водородно-кислородного элемента, можно создать условия, в которых электроны будут двигаться по металлическому проводнику и совершать работу. Это достигается в гальваническом элементе, где цинковый электрод погружен в раствор ZnSO4, а медный электрод в раствор СиSO4.
Растворы отделены друг от друга пористой (керамической) перегородкой, препятствующей их смешению, но обеспечивающей прохождение электрического тока вследствие диффузии ионов через поры. Такой элемент, на электродах которого образуются двойные электрические слои, был сконструирован русским электрохимиком Б.С. Якоби.
Величина и знак электрических зарядов в двойных слоях пределяются работой удаления электрона из металла и энергией гидратации его ионов. В раствор легко будут переходить те металлы, у которых меньше работа выхода электронов и больше энергия гидратации ионов, т.е. менее благородные металлы. Так как цинк менее благороден, чем медь, то он зарядится более отрицательно по сравнению с медью. Если соединить оба электрода металлическим проводником, то электроны будут перемещаться от цинка к меди. Вследствие этого ионы цинка Zn2+ не удерживаются в двойном слое притяжением электронов, переходят в объем раствора, а перешедшие на медный электрод электроны разряжают ионы Cu2+, переводя их в металлическое состояние.
Следовательно, в процессе работы элемента происходит растворение цинкового электрода и осаждение меди на медном электроде. Чтобы элемент работал, цепь должна быть замкнутой, т.е. между растворами должен быть электрический контакт. Перенос тока внутри элемента осуществляется ионами. В элементе переход электронов от цинка к меди происходит не в условиях непосредственного контакта этих металлов, а при помощи проводника. Суммарная реакция в элементе складывается из двух пространственно разделенных электродных процессов.
Реакции, протекающие в гальванических элементах являются окислительно-восстановительными. В рассматриваемом случае окисляется цинк, который теряет электроны, а восстанавливается медь, приобретающая электроны. Вообще любая окислительно-восстановительная реакция может быть использована для получения электрического тока с помощью гальванического элемента. Как упоминалось, такой реакцией может быть горение любого вида топлива.
При схематической записи гальванических элементов границы между фазами отмечаются вертикальными линиями. При условии, что на границе двух жидкостей (в данном случае растворов ZnSO4 и CuSO4) нет разности потенциалов, ее обозначают двумя вертикальными линиями. Схема рассмотренного элемента имеет следующий вид:
Zn ∣ ZnSO4 ∥ CuSO4 ∣ Cu.
Принято записывать подобные схемы таким образом, чтобы левый электрод был отрицательным (электроны текут по металлическому проводнику слева направо и в том же направлении переносится ионами положительное электричество внутри элемента). Такая запись отвечает протеканию реакции, сопровождающейся убылью энергии Гиббса и положительной величине э. д. с.
Гальванические элементы могут быть построены не только с использованием водных растворов электролитов, но и с, применением расплавов. Примером такого элемента может служить цепь Ag ∣ AgBr ∣ Br2, в которой левый электрод серебряный, а правый - представляет собой графит, омываемый газообразным бромом, а электролитом является расплавленное AgBr. На левом электроде растворяется серебро: Agт → Ag+ + e, а на правом - адсорбированный графитом бром: 1/2Br2г + e = Br-. Таким образом, в элементе происходит реакция: Agт + 1/2Br2г = AgBrж.
В последнее время приобрели большое значение гальванические элементы с твердыми электролитами, имеющими кислородную проводимость (см. гл. VIII), например,
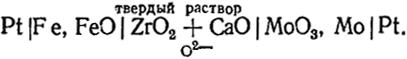
Левый электрод представляет собой смесь железа и его оксида. Здесь происходит реакция окисления железа ионами О2-, приходящими через твердый электролит. При этом освобождаются электроны, и электрод получает отрицательный заряд. На правом электроде, состоящем из смеси Мо и МоО3, происходит восстановление оксида. Это сопровождается поглощением электронов таким образом, что электрод заряжается положительно, а освободившиеся ионы О2 могут мигрировать через электролит к левому электроду. Реакция на электроде изображается следующим уравнением 3Feт + 3О2- = 3FеОт + 6е; на правом электроде: МоО3т + 6е = Мот + 3О2-.
Заметим, что сумма этих двух реакций 3Fет + МоОт = 3FеОт + Мот есть процесс восстановления оксида молибдена железом, самопроизвольное протекание которого является источником электрической энергии производимой элементом.
Из рассмотренных примеров видно, что реакцию, протекающую в гальваническом элементе, можно представить в виде двух отдельных электродных реакций.
Можно предположить, что э. д. с. гальванического элемента должна зависеть от природы реагирующих веществ, их концентраций и температуры. Чтобы найти выражения для этих зависимостей, необходимо рассмотреть термодинамические соотношения, характеризующие работу гальванического элемента.
Пусть в гальваническом элементе протекает реакция: M + Nn+ = Mn+. Работа, производимая элементом при расходе 1 моля М, определяется произведением количества электричества nF на величину э. д. с. Е, т.е. W = nFE, где п - число молей электронов, протекающих через цепь; F - число Фарадея, равное 96493 Кл. Например, для реакции Zn + Cu2+ = Zn2+ + Cu, n = 2. Если элемент работает обратимо при постоянных давлении и температуре, то произведенная им работа равна убыли энергии Гиббса, т.е. ДG = W:
ДG = -nFE = -96493E. (IX.1)
Если элемент работает необратимо, то nFE < -ДG, т.е. э.д.с. меньше, чем при обратимом проведении реакции. Выражая E в В, получаем величину ДG в Дж.
Таким образом, если известно стехиометрическое уравнение протекающей в гальваническом элементе реакции и табличные данные об изменении энергии Гиббса, можно рассчитать э. д. с.
Так, для рассмотренного выше водородно-кислородного элемента, работающего за счет энергии, освобождающейся при реакции Н2г + 1/2О2г = Н2Ож, для которой ДG 0
298 = -237200 Дж, п = 2, рH2 = рO2 = 1.
E = -ДG 0
298
/n·96493 = -(-237200/2)·96493 −∼ 1,2 В.
Из уравнения IX.1 следует, что измерение э. д. с. гальванического элемента позволяет найти изменение энергии Гиббса протекающей в нем реакции. Поэтому метод э. д. с. широко используется для определения термодинамических свойств веществ.
В приведенном выше примере этот метод позволяет найти ДG реакции восстановления МоО3 железом. Зная стандартное изменение энергии Гиббса при образовании FеО(ДG 0 f FeO) по найденному значению ДG, можно найти энергию Гиббса образования МоО3 из уравнения:
ДG = 3ДG 0
f
FeO - ДG 0
f
МоО3
Зависимость э. д. с. от температуры. Поскольку энергия Гиббса есть функция температуры, то и э. д. с. гальванического элемента также должна зависеть от температуры.
Для нахождения этой зависимости воспользуемся уравнением Гиббса-Гельмгольца: ДG = ДH + T(∂ДG/∂T)p подставив в него выражение ДG через э. д. с. При этом получим -nEF = ДH - TnF(dE/dT) или
-ДH = nF[E - Т (dE/dT)], (IX.2)
или
-ДH = W - TnF(dE/dT). (IX.3)
Сначала представим себе, что гальванический элемент, помещенный в калориметр, является коротко замкнутым. В этом случае производимая им электрическая энергия полностью превратится в тепло, количество которого равно энтальпии реакции ДH, и, следовательно, работа будет равна нулю.
Пусть теперь реакция в элементе осуществляется обратимо, например, провода от электродов выведены из калориметра, подведены к мотору, и электрический ток производит работу. Тогда часть освобождающейся при реакции энергии превратиться в электрическую работу W, а другая часть Q останется в виде тепла и будет измерена в калориметре. Согласно первому закону термодинамики
-ДH = W - Q (IX.4)
Сопоставление уравнений (IX.3) и (IX.4) показывает, что
Q = TnF(dE/dT). (IX.5)
Очевидно, чем ближе протекание реакций в гальваническом элементе к условиям обратимости, тем бо́льшая часть ДG превращается в работу. Величина Q, которая характеризует связанную энергию, определяет количество тепла, неизбежно выделяющегося (или поглощающегося) в том случае, когда элемент работает обратимо. Так как (∂ДG/∂T)р = -ДS и (∂ДG/∂Т)р = -пF(dЕ/dТ), то
ДS = nF(dE/dT), (IX.6)
и, следовательно, измерения температурной зависимости э. д. с. позволяют вычислить изменение энтропии при реакции, протекающей в гальваническом элементе. Следует подчеркнуть, что гальванический элемент может работать как с выделением, так и с поглощением тепла. В последнем случае он превращает в работу тепло окружающей среды. Это не находится в противоречии со вторым законом термодинамики, так как процессы в гальванических элементах не являются непрерывными и прекращаются при израсходовании материала электродов.
Знак и величина Q определяют температурную зависимость э. д. с. Если при работе элемента выделяется тепло, т.е. Q < 0, то температурный коэффициент э. д. с. dE/dT < 0. Это наиболее часто встречающийся случай, так как большинство элементов работает с выделением тепла. Наоборот, при Q > 0 э. д. с. растет с температурой.
Для гальванических элементов, служащих в качестве эталонов, при электрических измерениях подбирают такие реакции, в которых Q весьма мало и dЕ/dТ близко к нулю. Так, зависимость э. д. с. от температуры широко используемого стандартного элемента Вестона выражается уравнением:
E = 1,0183 - 0,0000406 (t - 20) В.
Он составлен по схеме: Cd ∣ CdSO4 ∣ ∣ Hg2SO4 ∣ Hg, и в нем протекает реакция Cdт + 2Hg+ = Cd2+ + 2Hgж1.
В качестве примера применения уравнений (IX.4) и (IX.5) вычислим величину dE/dT для элемента, в котором протекает реакция Znт + 2AgCl = ZnCl2 + 2Agт
-ДH = 217760 Дж, а E = 1,015 В при 0° C. Отсюда
-Q = -ДH = 217760 - 2·96493·1,015 = 21880 Дж.
dE/dT = -218807(273·2·96493) −∼ - 4·10-4 В/К.
Примером элемента с положительным температурным коэффициентом является ячейка Hg ∣ Hg2Cl2, KCl ∣ KOH ∣ Hg2O ∣ Hg, в которой протекает реакция Hg2Cl2 + 2KOH = 2KCl + Hg2O + H2O.
Левый электрод этого элемента называемый каломельным, часто используется в электрохимических измерениях. Он состоит из жидкой ртути, находящейся в контакте с твердой каломелью Hg2Cl2 и водным раствором какого-либо сильного электролита, например KС1. Реакция, идущая в рассматриваемом элементе, является эндотермической, ДH = 13720 Дж, а W = 31570 Дж. Таким образом Q = 13720 + 31570 = 45240 Дж, т.е. элемент поглощает из окружающей среды тепло, равное 45240 Дж. Часть этого тепла, равная 31570 Дж, идет на производство работы.
Зависимость э. д. с. от концентраций электролитов, участвующих в реакции, может быть: найдена при помощи уравнения изотермы химической реакции.
Пусть в гальваническом элементе протекает реакция A + B = 2D, при этом ДG = RTlnK + RTln (c 2 D/cAcB). Подставляя вместо ДG величину - nEF и разделив обе части уравнения на -пF, получим E = RTln(K/nF) - [RT/nFln (c 2D/cAcB)]. или, обозначая величину RTlnK/nF, зависящую только от температуры, через E0, будем иметь:
E = E0 - (RT/nF[ln(c 2 D/ cAcB)]. (IX.7.)
Величина E0 называется стандартной э. д. с. элемента. Она характеризует элемент, в котором концентрации всех участвующих в реакции веществ равны единице, а изменение энергии Гиббса равно стандартному ДG0. Заменив в уравнении (IX.7) натуральный логарифм десятичным, получим для температуры 25 °C.
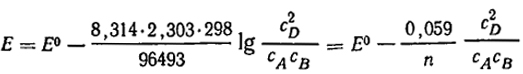
Очевидно, что для электролитов нельзя просто пользоваться аналитическими концентрациями соответствующих веществ, а необходимо учитывать диссоциацию и взаимодействие ионов. В связи с этим возникает задача определения активности электролитов.
Похожие работы
... подкрепляет своим одобрением неправильный или не вполне точный ответ ученика. 1.2 Совершенствование школьного химического эксперимента при проблемном обучении 1.2.1 Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения Характерной особенностью развивающего обучения является широкое использование проблемного подхода, который включает создание ...
ависимо от способа получения и места нахождения. 2. Строение внешнего электронного уровня атома калия и кальция. 1 правило Клечковского. Строение внешнего электронного уровня атома скандия. 2правило Клечковского У атома аргона остаются незанятыми все орбитали 3d-подуровня. Однако у следующих за аргоном элементов – калия и кальция – заполнение 3-го электронного слоя временно прекращается, и ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... учреждение страны, а в ее задачи входило усовершенствование наук, просвещение, а также усовершенствование мануфактур, ремесел и фабрик. В то же время в начале XIX столетия, особенно после Отечественной войны 1812 г., в развитии химии в России появились новые черты. Смена мануфактурного производства фабрично-заводским выдвинула перед учеными множество практических задач, связанных с рациональной ...





0 комментариев