Навигация
Внутренняя энергия
1.4. Внутренняя энергия
Важной характеристикой состояния системы является ее внутренняя энергия. Она определяется как среднее значение полной энергии ее частиц. Во внутренней энергии можно выделить следующие составляющие:
· энергия поступательного, вращательного и колебательного движений атомов и молекул;
· энергия межмолекулярного взаимодействия;
· энергия связи атомов в молекулах (химическая энергия);
· энергия связи электронов в атомах;
· энергия связи атомных ядер и др.
При различных процессах, происходящих в системе, происходят изменения внутренней энергии. Как правило, это происходит из-за изменения одной или нескольких составляющих внутренней энергии, поэтому и в самой внутренней энергии следует учитывать только те составляющие, которые изменяются в ходе процесса. Отметим общие свойства внутренней энергии:
1. в состоянии теплового равновесия движение частиц системы таково, что в любой момент времени полная энергия частиц с высокой степенью точности равна внутренней энергии (статистические флуктуации очень малы);
2. внутренняя энергия системы является функцией ее термодинамических параметров;
3. внутренняя энергия обладает свойством аддитивности, т.е. внутренняя энергия системы равна сумме внутренних энергий частей (макроскопических), составляющих данную систему.
Определим внутреннюю энергию идеального газа в равновесном состоянии – это энергия поступательного, вращательного и колебательного движений атомов и молекул. Поступательное движение частиц газа носит классический характер, а вращательное и колебательное движение – квантовый, т.е. такие движения возникают только про сообщении молекулам конечной порции энергии DЕ. Для большинства газов DЕкол~ 10-20Дж, что соответствует температуре Ткол ~10 3К, DЕвр~10-21Дж, а температура Твр ~10 К. Общая закономерность квантовых движений следующая: с ростом температуры квантовое движение быстро приобретает классический характер. Поэтому при обычных условиях можно движение молекул считать классическим и для вычисления внутренней энергии воспользоваться законом равнораспределения энергии по классическим степеням свободы.
«В состоянии теплового равновесия на каждую поступательную и вращательную степень свободы приходится в среднем энергия равная кТ/2. а на колебательную – кТ».
Числом степеней свободы называется минимальное количество координат, однозначно определяющих положение тела (системы) в пространстве, или количество независимых движений, благодаря которым тело обладает энергией. В атомарном газе каждый атом имеет три поступательных степени свободы, в газе с двухатомными молекулами – каждая молекула имеет три поступательных и две вращательных степени свободы, в газе с многоатомными молекулами, в общем случае, - три поступательных и три вращательных. Тогда внутренняя энергия газ имеет вид
U = N![]() =
= ![]() ,
,
где i – число степеней свободы молекул газа.
1.4. Статистические распределения.
При тепловом движении положения частиц, величина и направление их скоростей изменяются случайным образом. Вследствие гигантского числа частиц, случайный характер их движения, проявляется в существовании определенных статистических закономерностей в распределении частиц системы по координатам, значениям скоростей и т.д. Подобные распределения характеризуются соответствующими функциями распределения. Функция распределения (плотность вероятности) характеризует распределения частиц по соответствующей переменной (координаты, величины скоростей и т.д). В основе классической статистики лежат следующие положения:
· все частицы классической системы различимы (т.е. их можно пронумеровать и следить за каждой частицей);
· все динамические переменные, характеризующие состояние частицы, изменяются непрерывно;
· в заданном состоянии может находиться неограниченное число частиц.
1.4.1. Распределение Максвелла.
В состоянии теплового равновесия как бы не изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул в газе, при Т=cоnst, остается постоянной и равной 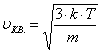 . Это объясняется тем, что в газе, устанавливается некоторое стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла. Распределение Максвелла описывается некоторой функцией f(u), называемой функцией распределения молекул по скоростям.
. Это объясняется тем, что в газе, устанавливается некоторое стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла. Распределение Максвелла описывается некоторой функцией f(u), называемой функцией распределения молекул по скоростям.
![]() ,
,
где N – общее число молекул, dN(u)- число молекул, скорости которых принадлежат интервалу скоростей от u до u + du.
Таким образом, функция Максвелла f(u) равна вероятности того, что величина скорости наугад выбранной молекулы принадлежит единичному интервалу скоростей вблизи значения u. Или она равна доле молекул, скорости которых принадлежат единичному интервалу скоростей вблизи значения u.
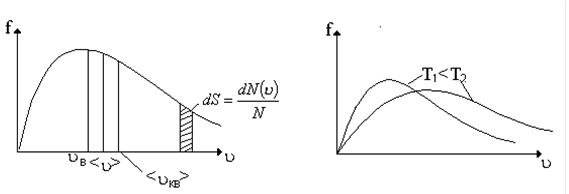
рис.12 рис. 13
Явный вид функции f(u) был получен теоретически Максвеллом
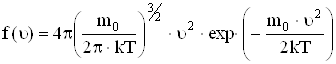 .
.
График функции распределения приведен на рис.12. Из графика следует, что функция распределения стремится к нулю при u®0 и u®¥ и проходит через максимум при некоторой скорости uВ, называемой наиболее вероятной скоростью. Этой скоростью и близкой к ней обладает наибольшее число молекул. Кривая несимметрична относительно uВ.
Значение наиболее вероятной скорости можно найти, используя условие для максимума функции f(u).
![]() .
.
На рис. 13 показано смещение uВ с изменением температуры, при этом площадь под графиком остается постоянной и равной 1, что следует из условия нормировки функции Максвелла
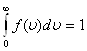 .
.
Условие нормировки следует из смысла данного интеграла – он определяет вероятность того, что скорость молекулы попадает в интервал скоростей от 0 до ¥. Это достоверное событие, его вероятность, по определению, принимается равной 1. Знание функции распределения молекул газа по скоростям позволяет вычислять средние значения любых функций скорости, в частности средней арифметической скорости <u>.
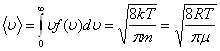 .
.
По функции Максвелла можно определить долю молекул, скорости которых принадлежат заданному интервалу скоростей или превышают некоторое значение скорости, например, вторую космическую, что определяет рассеяние атмосферы.
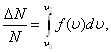
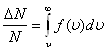 .
.
Похожие работы
... значениями этих параметров, чтобы определить предельные значения и шаг расчёта рассчитываемых параметров. Заключение Хочется выразить уверенность, что в следующих версиях курса "Открытая физика" количество компьютерных моделей будет расти, их функциональные возможности станут разнообразнее, а пределы изменения числовых значений параметров, описывающих эксперименты, будут расширены. Надеемся, что ...
... это количество вещества, взятая в количестве 1 моля. g - количество вещества или число молей. [g]= моль [m]= кг/моль Билет № 7 1. Важным понятием в молекулярной физике и термодинамике является понятие термодинамической системы, к рассмотрению которого мы и переходим. 1.Термодинамической системой (или просто системой) называют совокупность большого числа молекул, атомов или ионов ...
... что разрешало противоречие между результатами Гей-Люссака и Дальтона. Успехи учения об атомно-молекулярном строении вещества, в особенности, газов, безусловно, оказало влияние на становление термодинамики и молекулярной физики и способствовало развитию механической теории теплоты. Во второй половине 18 века господствовала теория теплорода, но уже в начале 19 века она стала уступать свои позиции ...
... : Будем считать величину , измеряемую в энергетических единицах, прямо пропорциональной температуре , выражаемой в градусах: , где - коэффициент пропорциональности. Коэффициент , в честь австрийского физика Л.Больцмана называется постоянной Больцмана. Следовательно, . Температура, определяемая этой формулой, не может быть отрицательной. Следовательно, наименьшим возможным значением температуры ...
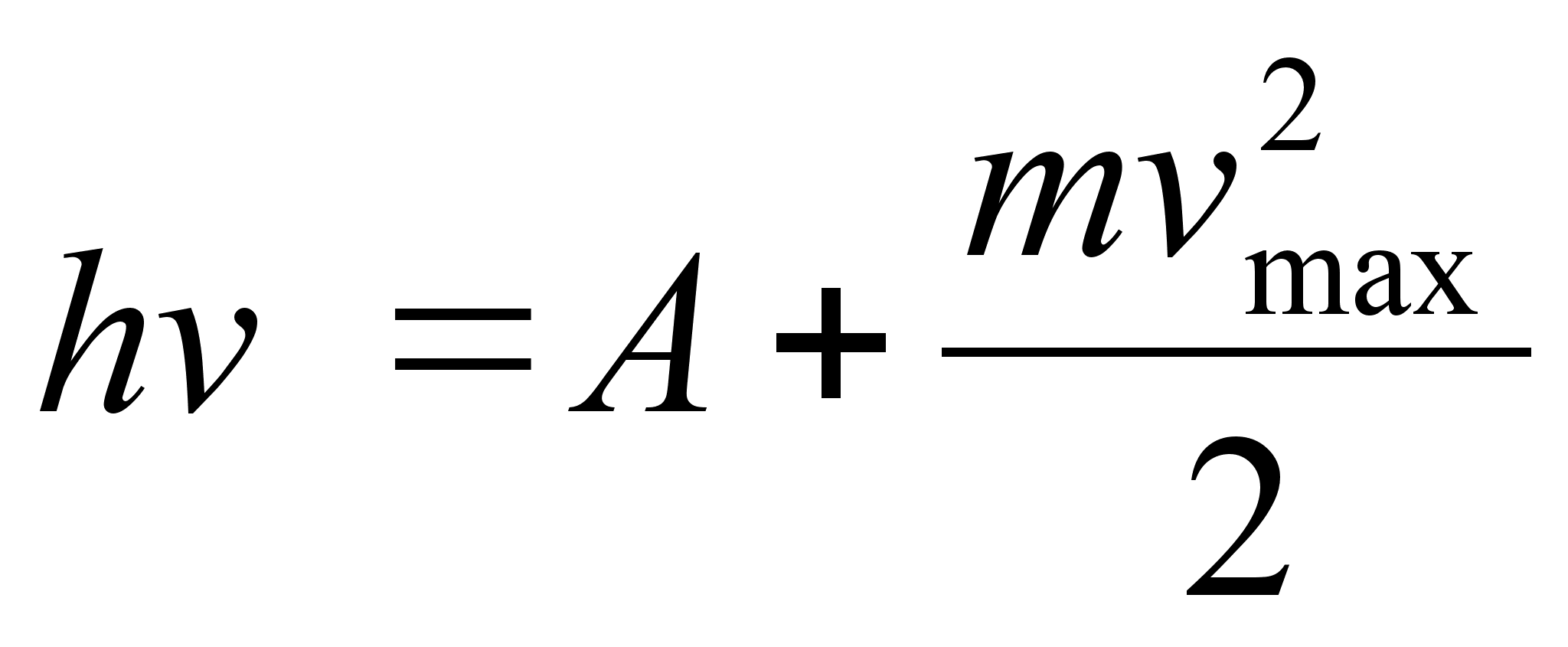


0 комментариев