Навигация
Применение первого начала термодинамики к изопроцессам
2.4. Применение первого начала термодинамики к изопроцессам
Изохорический процесс. (V = const). Газ не совершает работу, т.е. dA=0. Из первого начала термодинамики следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
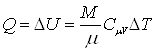 .
.
Изобарический процесс (p = const). Теплота, сообщенная газу, идет на приращение внутренней энергии и на совершение работы над внешними телами
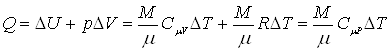 .
.
Изотермический процесс (T = const). Внутренняя энергия газа не изменяется и все количество тепла, сообщаемое газу, расходуется на совершение им работы против внешних сил:
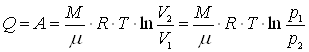 .
.
2.5. Адиабатический процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен
(dQ = 0) между физической системой и окружающей средой. Близкими к адиабатическим являются все быстропротекающие процессы. Из первого начала термодинамики для адиабатического процесса следует, что ![]() , т.е. работа совершается за счет убыли внутренней энергии системы. Используя первое начало термодинамини и соотношение (44) можно получить уравнения адиабатического процесса
, т.е. работа совершается за счет убыли внутренней энергии системы. Используя первое начало термодинамини и соотношение (44) можно получить уравнения адиабатического процесса
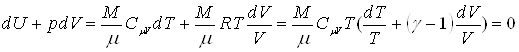
 .
.
Вычислим работу, совершаемую газом в адиабатическом процессе. Если газ расширяется от объема V1 до V2, то его температура падает от T1 до T2 и работа расширения идеального газа
![]() .
.
Это выражение для работы при адиабатическом процессе можно преобразовать к виду
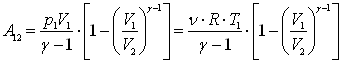 .
.
2.6. Обратимые и необратимые процессы. Коэффициент полезного действия теплового двигателя.
К обратимым процессам относятся процессы, после проведения которых в прямом и обратном направлениях в окружающих систему телах не остается никаких изменений. Для обратимых процессов характерно следующее: если в ходе прямого процесса система получила количество тепла Q и совершила работу А, то в ходе обратного процесса система отдает количество тепла Q¢=-Q и над ней совершается работа А¢=-А. К обратимым процессам относятся все равновесные процессы. В случае необратимого процесса, после возвращения системы в исходное состояние, в окружающих систему телах остаются изменения (изменяются положения тел и их температуры). Все реальные процессы в большей или меньшей степени необратимы.
В процессе преобразования тепла в работу используется тепловой двигатель, работающий по какому либо круговому процессу (циклу). Коэффициент полезного действия такого двигателя (термический К.П.Д.) определяет долю тепла, превращаемую в работу.
 ,
,
где А - работа, совершенная двигателем за цикл, Q1- количество тепла, полученного двигателем, Q¢2- количество тепла, отданного двигателем в окружающую среду.
Работу теплового двигателя можно представить на диаграмме состояний в виде некоторого теплового кругового процесса (рис.19).
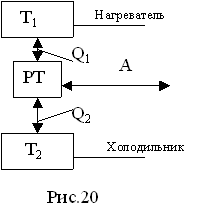
 Общая работа А определяется площадью цикла 1а2в1. Если за цикл совершается А>0, то цикл называется прямым, и если А<0, – обратным.
Общая работа А определяется площадью цикла 1а2в1. Если за цикл совершается А>0, то цикл называется прямым, и если А<0, – обратным.
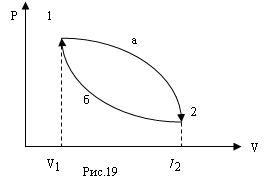
Прямой цикл используется в тепловом двигателе, совершающем работу за счет получения извне теплоты. Обратный цикл используется в холодильных машинах, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой (рис.20).
Важной задачей термодинамики является изучение процессов преобразования тепла в работу и установления возможных границ повышения термического К.П.Д.
2.7. Второе начало термодинамики
Анализ выражения для К.П.Д. показывает, что максимальный К.П.Д. равный 1 возможен, если двигатель все получаемое количество тепла будет преобразовывать в работу. Все опытные факты свидетельствуют о невозможности создания такого двигателя (вечный двигатель второго рода) и это было сформулировано в виде второго начала термодинамики.
«Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара»
Вильям Томсон (лорд Кельвин).
«Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому»
Рудольф Клаузиус.
Второе начало термодинамики не только установило границы преобразования тепла в работу, но и позволило построить рациональную шкалу температур (термодинамическая шкала температур) и установить направление процессов, происходящих в теплоизолированных системах.
Похожие работы
... значениями этих параметров, чтобы определить предельные значения и шаг расчёта рассчитываемых параметров. Заключение Хочется выразить уверенность, что в следующих версиях курса "Открытая физика" количество компьютерных моделей будет расти, их функциональные возможности станут разнообразнее, а пределы изменения числовых значений параметров, описывающих эксперименты, будут расширены. Надеемся, что ...
... это количество вещества, взятая в количестве 1 моля. g - количество вещества или число молей. [g]= моль [m]= кг/моль Билет № 7 1. Важным понятием в молекулярной физике и термодинамике является понятие термодинамической системы, к рассмотрению которого мы и переходим. 1.Термодинамической системой (или просто системой) называют совокупность большого числа молекул, атомов или ионов ...
... что разрешало противоречие между результатами Гей-Люссака и Дальтона. Успехи учения об атомно-молекулярном строении вещества, в особенности, газов, безусловно, оказало влияние на становление термодинамики и молекулярной физики и способствовало развитию механической теории теплоты. Во второй половине 18 века господствовала теория теплорода, но уже в начале 19 века она стала уступать свои позиции ...
... : Будем считать величину , измеряемую в энергетических единицах, прямо пропорциональной температуре , выражаемой в градусах: , где - коэффициент пропорциональности. Коэффициент , в честь австрийского физика Л.Больцмана называется постоянной Больцмана. Следовательно, . Температура, определяемая этой формулой, не может быть отрицательной. Следовательно, наименьшим возможным значением температуры ...


0 комментариев